
3.有关嫦娥一号卫星到达48小时周期轨道时绕地速度的叙述正确的是: ( )
A.17时40分是该卫星在48小时周期轨道公转线速度最慢的时候
B.17时40分是该卫星在48小时周期轨道公转角速度最快的时候
C.此时地球的公转速度正在逐渐减慢
D.48小时周期轨道的近地点是该轨道上嫦娥1号绕地速度最慢的时候
2.四地中,发射“嫦娥一号”的基地和最适合发射地球同步卫星的基地分别是 ( )
A.甲、乙 B.乙、丙 C.丙、甲 D.丙、乙
据材料二回答第3题。
材料一:2007年9月22日,新华社消息,我国将在海南省文昌市建设新航天发射场。建成后,它将成为我国继酒泉、太原、西昌之后的第四个航天发射中心。
材料二:2007年10月24日(农历九月十四)北京时间18:05在我国四川某一航天发射中心成功发射了嫦娥一号月球卫星,30日17时40分,嫦娥一号卫星到达48小时周期轨道远地点,即距地面高度12万公里处,11月7日,嫦娥一号卫星正式进入距月球200公里的工作轨道,这一壮举标志着中国成为第五个迈入“月球俱乐部”的国家。读下图1,完成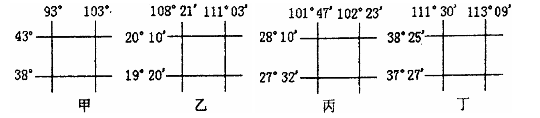 1、2题。
1、2题。
1.四地作为航天发射中心的优势,正确的是 ( )
A.甲--晴天多,地形平坦
B.乙--海拔高,便于运输大体积火箭
C.丙--空气洁净,交通便利
D.丁--纬度低,海拔高,自转速度大
31.某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 moL HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是_____________。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是_____________mL,沉淀的最大质量是_____________g(用含a的代数式表示)
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数(写出计算过程)。
30.生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO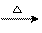 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是_____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
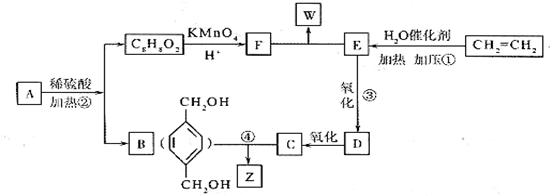
29.A、B、C、D、E、F、G、H、I、J均为有机化合物。根据图回答问题:
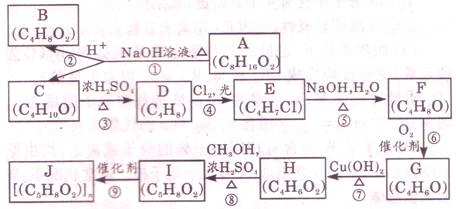
(1)B和C均为有支链的有机化合物,B的结构简式为_____________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为_____________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为_________。
(3)⑤的化学方程式是_______________________________________;⑨的化学方程式是_______________________________________。
(4)①的反应类型是_____________,④的反应类型是_____________,⑦的反应类型是_____________。
(5)与H具有相同官能团的H的同分异构体的结构简式为_____________。
28.
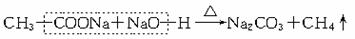
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
回答下列问题:
(1)写出反应①的反应类型:_____________。
(2)1mol F最多可与_____________ mol NaOH溶液反应。
(3)写出③的化学反应方程式:_______________________________________。
(4)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为:
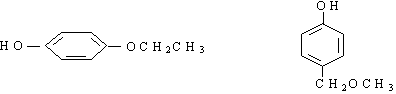
__________________________,__________________________。
(5)A的结构简式可能为(只写一种即可) __________________________。
27.食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
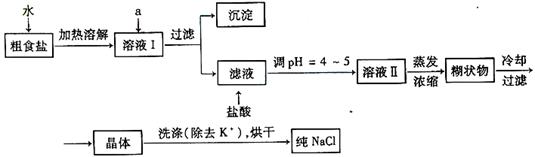
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为__________________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________。
(2)用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有_____________(填仪器名称)。
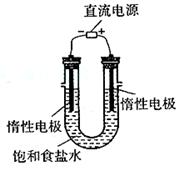
(3)电解饱和食盐水的装置如图所示,若收集的H2为
2L,则同样条件下收集的Cl2 _____(填“>”、
“=”或“<”=2L,原因是__________________
________。装置改进后,可用于制备NaOH溶液,若
测定溶液中NaOH的浓度,常用的方法为_________
_____________。
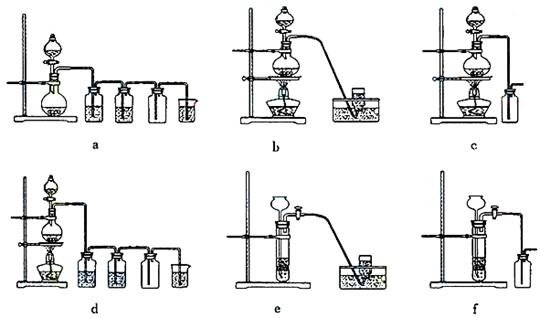
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_____________(填代号)和制备并收集干燥、纯净Cl2的装置_____________(填代号)。
可选用制备气体的装置:
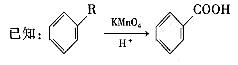
26.为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将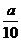 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。请回答下列问题:
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为_____________和_____________;(铁的相对原子质量以55.9计)
(3)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________(填“准确”“不准确”“不一定准确”),理由是__ _____;
②方案二_________(填“准确”“不准确”“不一定准确”),理由是________________。
25.将一定量的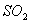 和含0.7mol氧气的空气(忽略
和含0.7mol氧气的空气(忽略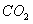 )放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:
)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应: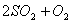
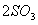 (正反应放热)。反应达到平衡后,将容器中的混合气体通过过量
(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量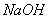 溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收
溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收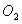 ,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是_____________。(填字母)
a.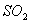 和
和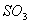 浓度相等 b.
浓度相等 b.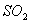 百分含量保持不变
百分含量保持不变
c.容器中气体的压强不变 d.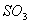 的生成速率与
的生成速率与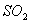 的消耗速率相等
的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高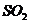 的转化率,下列措施可行的是_____________。(填字母)
的转化率,下列措施可行的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)该反应达到平衡时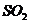 的转化率_____________(用百分数表示)。
的转化率_____________(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的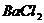 溶液,生成沉淀_____________克。
溶液,生成沉淀_____________克。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com