
14. 复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以
生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 (填编号)
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
(填编号),其pH为 (填数值);pH最大的是 (填编号);
①HClO4 ②CH3COOH ③HCN ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一个规律:
。
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式: 。
II.设计出燃料电池使汽油氧化直接产生电流是对21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)以庚烷(C7H16)代表汽油,这个电池放电时发生的化学反应的化学方程式是:
(2)这个电池的负极发生的反应是:C7H16+22O2--44e-=7CO2+8H2O
正极发生的反应是:
固体电解质里的O2-向 极移动
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
13. 在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64kJ的热量
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
 N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++
N2H4+H3O+=N2H5++H2O N2H4+H2O N2H5++

 N2H5++H2O N2H62++
N2H5++H2O N2H62++ N2H5++H2O N2H4+H3O+
N2H5++H2O N2H4+H3O+
据此可得出的结论是 。
A.肼水解显酸性 B.肼在水中可电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式 。
(3)已知H2O(1)=H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式
,该反应的还原产物是 。
12. 已知2SO2(g)+
O2(g)  2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
A.Q2= 1/2 Q1=98.5 B.Q2=1/2 Q1<98.5 C.Q2<1/2 Q1<98.5 D.1/2 Q1< Q2 <98.5
11.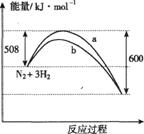 右图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是(
)
右图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是(
)
A.该反应的热化学方程式为:N2+3H2 2NH3 △H=-
2NH3 △H=-
92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后
放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放
出的热量为Q2kJ则184>Q2>2Q1
10.下列依据热化学方程式得出的结论正确的是 ( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ· mol-1
则氢气的燃烧热为241.8 kJ· mol-1
B.已知C(石墨,s)=C(金刚石,s);△H>0 则金刚石比石墨的键能大
C.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ· mol-1
则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g);△H1
2C(s)+O2(g)=2CO(g);△H2,则△H1>△H2
1.60 mol
9. 用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4 ( g ) + 4NO2 ( g ) = 4NO ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一574kJ·mol-1
② CH4 ( g ) + 4NO ( g ) = 2N2 ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一1160kJ·mol一1
下列说法不正确的是 ( )
A.由反应 ① 可推知:CH4 ( g ) + 4NO2 ( g ) = 4NO ( g ) + CO2 ( g ) + 2H2O ( l) ;
△H >一574 kJ·mol-1
B.反应 ①② 转移的电子数相同
C.若用标准状况下 4.48LCH4 还原 NO2至 N2,放出的热量为 173.4kJ。
D.若用标准状况下 4.48LCH4 还原 NO2至 N2,整个过程中转移的电子总数为
8. 下列叙述正确的是 ( )
A.糖尿病人应少吃含糖的食品,某八宝粥中注明未加糖,糖尿病人可以放心食用
B.反应2NO2(g)→ N2O4(l)的熵(体系混乱度)减小(即△S<0)
C.环境保护的根本是研究怎样将污染物质转化为有用物质
D.△H>0的化学反应一定不能自发进行
7. 已知常温常压下,N2(气)和H2(气)反应生成2molNH3(气)放出92.4kJ热量。在同温同压下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的密闭容器中通人0.5molN2、1.5molH2和1molNH3,相同条件下达到平衡时放出热量为Q2kI。则下列关系式正确的是 ( )
A.2Q2=Q1=92.4 B.Q2<Q1<92.4 C.Ql<Q2<92.4 D.Ql=Q2<92.4
6. 下列关于热化学反应的描述中正确的是:
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的
ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com