
5. 下列化学用语和叙述正确的是( )
A.M与N是同素异形体,由M=N;△H=+119KJ/mol可知,N比
M稳定
B.Na2O2的电子式: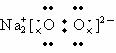
C.表示乙炔“燃烧热”对应的热化学方程式:
C2H2
(g)+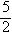 O2
(g)
O2
(g) 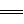 2CO2
(g)+H2O(g);△H=-1
256KJ/mol
2CO2
(g)+H2O(g);△H=-1
256KJ/mol
D.葡萄糖的实验式:CH2O
4. 下列说法正确的是
①用25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸;
②可用干燥的pH试纸测定氯水的pH;
③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大;
④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中-定有大量CO32-存在;
⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为: c(Na+)﹥ c(CH3COO-)﹥ c(OH-)﹥ c(H+);
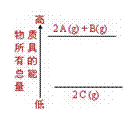 ⑥右图是反应物和生成物的能量变化示意图,其可能发生反 应的热化学方程式可表示为:2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )。 ( )
⑥右图是反应物和生成物的能量变化示意图,其可能发生反 应的热化学方程式可表示为:2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )。 ( )
A.①③⑥ B.②④⑤ C.①③④ D.③⑤⑥
3. 已知:
CH3 (CH2 )2CH3 ( g )+O2 ( g ) =4CO2 ( g ) + 5 H2O ( l );△H=-2878kJ·mol一1
(CH3)2CHCH3 ( g ) +O2 ( g ) =4CO2 ( g ) + 5 H2O ( l );△H = -2869 kJ·mol一1
下列说法正确的是( )
A.正丁烷的燃烧热为一2878kJ·mol一1
B.正丁烷分子所具有的能量大于异丁烷分子
C.等量的异丁烷分子中碳氢键比正丁烷的多
D.异丁烷转化为正丁烷的过程是一个放热过程
2. 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1molNN键吸收941kJ热量,则( )
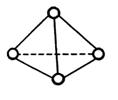 A.N4的熔点比P4高
A.N4的熔点比P4高
B.1molN4气体转化为N2时要吸收748kJ能量
C.N4是N2的同系物
D.1molN4气体转化为N2时要放出724kJ能量
1. 推动上千吨的火箭和进行长距离的太空飞行的巨大能量是从哪里来的?化学反应立下神功。火箭使用的燃料是偏二甲肼[(CH3)2NNH2],火箭升空时发生的化学反应为:
C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关该反应的说法正确的是
A.偏二甲肼既是氧化剂又是还原剂
B.该反应进行时只有放热过程没有吸热过程
C.该反应中氮元素的化合价升高
D.该反应中每生成1mol CO2转移8mol电子
16、(08cyym-27)(16分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
____________________________________________ 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
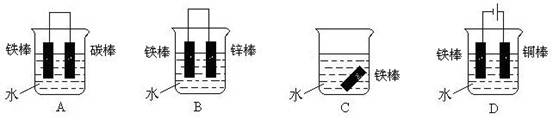
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
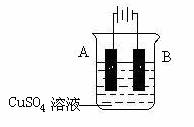
请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
15. 如图所示,烧杯中都盛有稀硫酸。
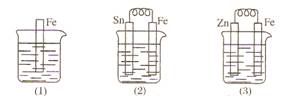
(1)中反应的离子方程式为_____________________。
(2)中反应的电极反应:Fe:_____________________,Sn:_____________________,Sn极附近溶液的pH___________(填“增大”、“减小”或“不变”)。
(3)中被腐蚀的金属是___________,其电极反应式为_____________________。比较图(1)(2)(3)中纯铁被腐蚀的速率由快到慢的顺序是_____________________。
14. 切过咸菜的钢刀未及时清洗,第二天刀上便出现锈斑,试用有关电极反应式、化学方程式表示Fe(OH)3的生成过程。
(1)负极______________________;正极______________________。
(2)化学方程式______________________、______________________。
13. 将金属A和金属B分别放入稀H2SO4中有氢气生成。若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀,B未被腐蚀。关于A、B的叙述正确的是( )
A. 金属活动性A>B
B. 还原性 B>A
C. 在后者装置中金属A发生还原反应,金属B发生氧化反应
D. 金属A表面有明显气泡产生,金属B表面无明显现象
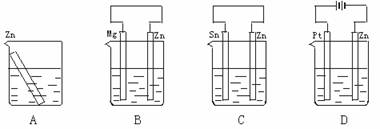
12. 分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com