
26. _____________ helps poor young girls return to school.
A. Project Hope B. Save China’s Tigers
C. Project Green Hope D. Spring Bud Project
25. I think more people should ________ to take part in the 2008 Olympic Games.
A. invite B. be invited C. invited D. to invite
24. The Chinese kid is so clever that he can understand ________the Americans say.
A. what B. how C. which D. whether
23. --- Why were you late for school today?
--- Oh, sorry. There was ______ wrong with my bike, so I had to walk to school.
A. something B. anything C. nothing D. everything
22. --- Where are you going this weekend?
--- I want______ to the World Park with my family. It will be great fun.
A. going B. to go C. go D. goes
从A、B、C、D四个选项中,选出可以填入空白处的最佳选项。
21. --- What happened last night?
--- ______18-year-old boy saved Sandy’s grandmother from the fire. The boy was brave.
A. the B. a C. an D. 不填
27、(10分)根据《中学化学》2009.9的文章《推理与实验不相符的两个问题》介绍:
将足量的铜片与一定量的浓硫酸共热反应,会不会出现随反应的进行硫酸浓度变稀而使反应停止,最终铜和硫酸都有剩余?
某研究性学习小组按下图定性实验简易装置进行实验探究,部分现象如下:
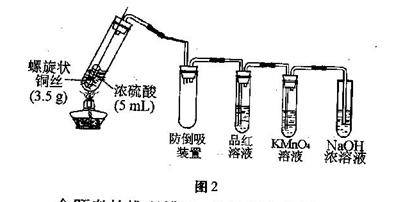
观察到:开始加热(浓硫酸未沸腾)时铜表面由光亮变黑,且黑色小颗粒扩散到浓硫酸中,并不断增多,当浓硫酸加热至沸腾时,黑色小颗粒逐渐溶解,溶液呈浅蓝色,继续加热时浅蓝色溶液逐渐变为灰白色悬浊液,液体量越来越少,最后全部变为灰白色固体。
查资料知:①浓硫酸沸腾温度为338℃,这是硫酸和水的恒沸点温度。②胆矾失去全部结晶水的温度为150℃.
请回答:(1)写出灰白色固体化学式
(2)反应过程中,可观察到品红溶液、KMnO4溶液褪色,这分别体现反应产生气体的 、
性质,其中气体与KMnO4溶液反应离子方程式:
(3)由上分析知:铜与浓硫酸共热,浓硫酸浓度 (填“会”或“不会”)变稀,因此 (填“会”或“不会”)出现反应自动停止,最终铜和硫酸都有剩余的现象。
(4)由上结论计算:将5ml 98%(密度为1.84g/cm3)的浓硫酸与足量的铜共热反应,产生气体的物质的量为( )
A.0.092mol B.0.046 mol C.小于0.046 mol D.大于0.046 mol,小于0.092 mol
诏安一中、长泰一中、龙海二中、平和一中、南靖一中五校联考
26、(13分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验
(1) 请完成以下实验设计表(表中不要留空格)。

|
实验 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(4)实验③得出的结论是:PH等于10时, 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
25、(12分)重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
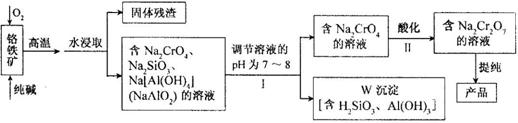
请回答下列问题。
⑴若Ⅰ中只用一种试剂调节溶液的pH,应选用 (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑵Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
(用离子方程式表示)。
⑶Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 氧化还原反应(填“是”或“不是”),反应的平衡常数表达式K= 。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Ag2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com