
23.(6分)FeS饱和溶液中存在如下平衡:FeS(s)  Fe2++S2- Ksp=8.1×10-17 mol2·L-2
Fe2++S2- Ksp=8.1×10-17 mol2·L-2
(1)理论上的FeS的溶解度为 。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2 [S2-]=1.0×10-22mol3·L-3,为了使饱和溶液里[Fe2+]达到1mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为__________________________。
22.(6分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答:
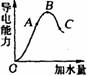 (1)“O”点导电能力为“0”的理由是
。
(1)“O”点导电能力为“0”的理由是
。
(2)A、B、C三点pH由大到小的顺序是_______________________。
(3)A、B、C三点电离度最大的是____________________。
21.(8分)下列物质:①能导电的有 ,②属于电解质的有 ,③属于非电解质的有 ,④属于强电解质的有 。
A.NaOH溶液 B.Cu C.液态HCl D.液态CH3COOH E.蔗糖 F.氨气
G.CuSO4 H.石墨 I.Na2O J.无水乙醇
20.5000C时,向甲容器中充入1molSO3,向相同容积的乙容器中充入1molSO2和0.5molO2。若甲容器保持容积不变,乙容器保持压强不变,分别达到平衡,下列说法正确的是 ( )
A.平衡时容器内的压强:甲>乙 B.平衡时容器内的压强:乙>甲
C.平衡时容器内O2的体积分数:乙>甲 D.平衡时容器内SO3的体积分数:甲>乙
第Ⅱ卷(非选择题,共 40分)
19.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能 ( )
A.生成一种强酸弱碱盐 B.弱酸溶液和强碱溶液
C.强酸与弱碱溶液反应 D.一元强酸溶液与一元强碱溶液反应
18.下列溶液中有关物质的量浓度关系正确的是 ( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) > 2c(H+) + c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
17.在一定体积pH=a的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,用去Ba(OH)2溶液与NaHSO4溶液的体积比为1:4,所得溶液pH为11,则a值等于 ( )
A.10 B.11 C.12 D.13
16.已知下列反应的热化学方程式为:①C(s)+O2(g)=CO2(g);△H1=-393.5kJ/mol ②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l);△H2=-870.3kJ/mol ③H2(g)+1/2 O2(g)=H2O(l);△H3=-285.8kJ/mol 则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为 ( )
A.+488.3kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.+244.15 kJ/mol
15.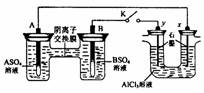 某同学按右图所示的装置进行试验。 A、B为两种常见金属,它们的硫酸盐可溶于
某同学按右图所示的装置进行试验。 A、B为两种常见金属,它们的硫酸盐可溶于 水。当 K 闭合时,在交换膜处 SO42一从
水。当 K 闭合时,在交换膜处 SO42一从 右向左移动。下列分析正确的是( )
右向左移动。下列分析正确的是( )
A.溶液中,A2+浓度减小 
B.B的电极反应:B-2e-=B2+ 
C.y电极上有 H2 产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
14.下列关于电解质电离的叙述中,正确的是 ( )
A.碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质
B.碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,所以水是非电解质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com