
2、综合实验方案设计
(1)明确实验目的和原理 必须认真审题,明确实验的目的要求,弄清题目有哪些新的信息,综合已学过的知识,通过类比迁移、分析,从而明确实验目的。 (2)选择仪器药品 根据实验目的,以及反应物和生成物的性质、反应条件(如反应物和生成物的状态、能否腐蚀仪器和橡皮、反应是否加热及温度是否控制在一定范围等),选择合理的化学仪器和药品。 (3)设计实验装置和实验步骤 根据上述实验目的和原理,以及所选用的实验仪器和药品,设计出合理的实验操作步骤。学生应具备识别和绘制和典型的实验仪器装置图的能力,实验步骤应完整而又简明。
(4)记录实验现象和实验数据 根据观察,全面准确的记录实验过程中的现象和数据。
(5)分析实验现象和数据,得出结论 根据实验观察的现象和记录的数据,通过分析、计算、图表、推论等处理,得出正确的结论。
1、制备实验方案设计 (1)设计要求 ①仪器简单、操作方便; ②实验条件适宜;-③节省试剂; ④安全防污; ⑤产品纯净、易于提纯;
(2)注意事项 在工业中,经常需考虑选择生产流程,除应考虑原料的用量、价格外,同时还应考虑反应所需的 条件,以及对设备的要求等,在以可行形为前提条件下,选择最佳方案。
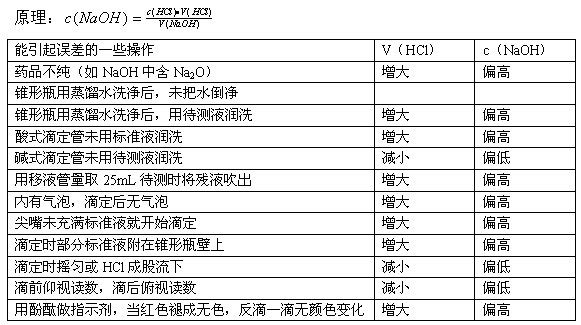
(二)酸碱中和滴定
[酸碱中和滴定原理]中学化学只要求掌握强酸与强碱的中和滴定,因此计算依据是:H+ + OH- = H2O
[酸碱中和滴定步骤]
[酸碱中和滴定注意事项]
①检查滴定管是否漏液。 ②滴定管装入溶液后,注意滴定管下端尖嘴部位有否气泡,如有应赶掉它,然后再记录初读数。 ③强碱滴定强酸时,一般用酚酞作指示剂;强酸滴定强碱时,常用甲基橙作指示剂。 ④在滴定过程中,如标准液滴在靠瓶口的内壁上,可用蒸馏水把它冲入瓶内。 ⑤如标准液滴在锥形瓶外或其他损失时,都应重做。
[酸碱中和滴定误差分析]
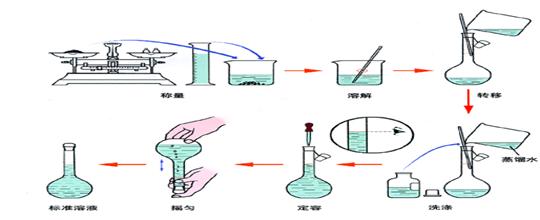
(一)一定物质的量浓度溶液的配制
配制步骤
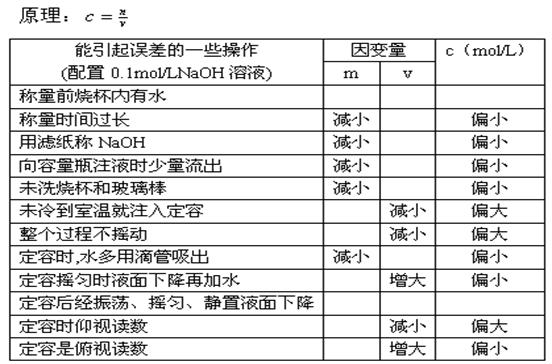
容量瓶的使用 1)选择合适的容量瓶
2)检验是否漏水
3)容量瓶的使用六忌:
___一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
___三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
___五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器)
溶液配制过程注意事项
___1)用量筒取液体试剂时,洗量筒的液体不能再倒入烧杯中 ___2)烧杯及玻璃棒的洗涤液要倒入容量瓶 ___3)在液面接近容量瓶的刻度线2-3cm时,应改用胶头滴管 ___4)读数时,视线应与溶液的凹液面恰好相切 ___5)容量瓶是配制溶液的容器,不是装试剂用的 ___6)若用浓硫酸配制稀硫酸时,一定要注意将浓硫酸慢慢用玻璃棒引流到水中。切不可相反操作!
配置一定物质的量浓度的溶液误差分析
|
物质 |
使用试剂 |
操作方法、现象、化学方程式 |
|
苯  |
①纯溴、铁屑 |
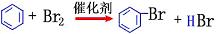 |
|
②浓硫酸、浓硝酸 |
加入浓硫酸、浓硝酸的混合溶液,振荡,加热,有黄色的苦杏仁气味的油状物硝基苯产生,沉于水底 |
|
甲苯 |
高锰酸钾酸性溶液 |
加少量待检物于高锰酸钾溶液中,紫红色褪去(注意与不饱和烃的区别:不饱和烃能使溴水褪色,而甲苯却不能) |
|
卤代烃 R-X |
氢氧化钠溶液,酸化的硝酸银 |
加入NaOH溶液,加热煮沸,加硝酸酸化后再加入硝酸银溶液,观察沉淀颜色 R-X + NaOH ──→R-OH + NaX |
|
乙醇  |
① 螺旋状铜丝 |
将螺旋状铜丝加热至表面有黑色的氧化铜生成,浸入试液,反复多次铜丝被还原后产生光亮的红色,并有刺激性气味产生。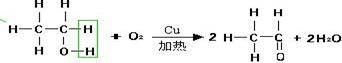 |
|
② 乙酸 |
②将乙醇、乙酸和浓硫酸混合物小心加热,把生成的气体通入饱和碳酸钠溶液,有透明油状、有果味液体浮在液面。 |
|
|
苯酚 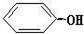 |
① 溴水 |
在试液中加入溴水,生成白色沉淀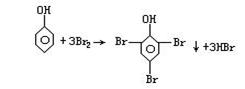 |
|
② 三氯化铁溶液 |
在试液中加入三氯化铁溶液,溶液变紫色。 |
|
|
乙酸 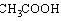 |
①纯碱 |
有气体生成 |
|
②乙醇 |
同乙醇② |
|
|
乙酸乙酯 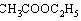 |
①水 |
有果香味,在水的上层。 |
|
②酚酞和氢氧化钠 |
加热后溶液的红色褪去。 |
|
|
蛋白质 |
浓硝酸 |
加少量浓硝酸,微热,蛋白黄色反应。 |
|
淀粉 |
碘水 |
溶液变蓝。 |
醛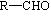 |
①银氨溶液 |
在盛有硝酸银的试管里,加少量氨水至有沉淀产生,再加氨水至沉淀刚好溶解,加入试液并加热,有光亮的银镜产生。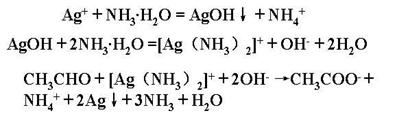 |
|
②新制的氢氧化铜 |
在盛有NaOH 溶液的试管里,滴加硫酸铜溶液数滴,振荡,然后加入试液少许,加热至沸,有红色沉淀产生。 |
|
葡萄糖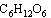 |
①银氨溶液 |
同醛 |
|
②新制的氢氧化铜 |
同醛,溶液开始呈绛蓝色,煮沸有红色沉淀产生 |
(五)实例:
I: 制氧发生装置(固+固、加热型)(可制备气体:O2、CH4、NH3)
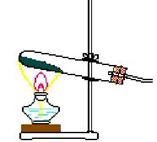 |
注意事项:
(1)试管口应略向下倾斜
(2)试管夹夹在试管的中上部;
(3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的气密性
(6)加热时,先预热且应用外焰加热
(7)实验结束,先撤导管,后撤酒精灯 |
氧气实验室制法及性质
氨气实验室制法及性质
II: 固体+液体(不加热)---- H2、CO2、SO2、H2S、C2H2
实验室制乙炔
实验室制乙炔注意事项: (1)C2H2不可用启普发生器 (2)C2H2发生装置导管口放一团棉花 (3)SO2可用该装置制备,不可用排水收集
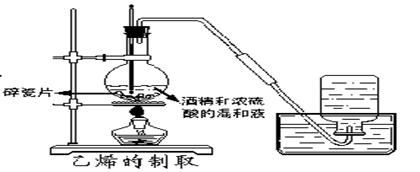
III: 固体(液体)+液体加热---- Cl2、HCl、CH2=CH2
氯气实验室制法
乙烯实验室制法
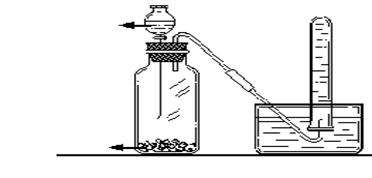
 实验室制取C2H2
实验室制取C2H2
(四)尾气吸收
(三)气体收集
1、排水法:
难溶于水的气体:H2、CH4、NO 、O2、N2、C2H2、CO、C2H4 2、排空气法:
向上排空气法:Cl2、HCl、CO2、SO2、H2S ----向下排空气法:H2、CH4、NH3
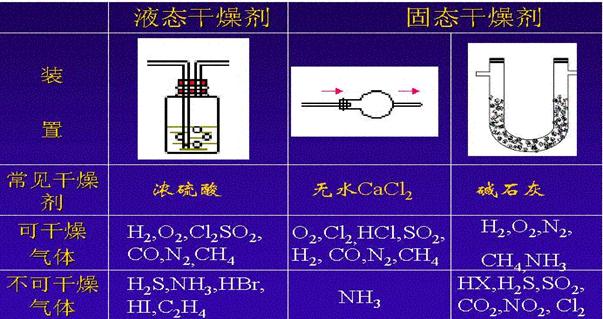
(二)常见干燥剂及使用原则
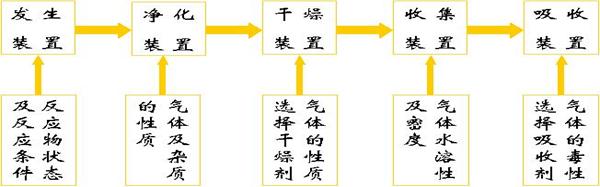
(一)常见气体的制取步骤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com