
16.(自贡市高2009级高三理科综合能力测试“一模”)
如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
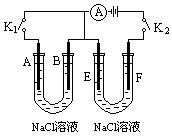 (1)打开K2,闭合K1。
(1)打开K2,闭合K1。
B为 极,A的电极反应为 ,最终可观察到的现象是 ,涉及的化学反应方程式有:
;
。
(2)打开K1,闭合K2。
E为___________极,F极的电极反应为________ __________,检验F极产生气体的方法是___________ ____________________。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是______________________________,原因是________________________ ____________ ______ 。
答案
(1)负 O2 + 2H2O +
4e- = 4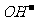 溶液中有红褐色沉淀生成
溶液中有红褐色沉淀生成
2Fe+ O2 +2H2O =2Fe(OH)2 ; 4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)阴 2Cl- - 2e- = Cl2↑
用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气
(3)AE
因为 A极产生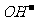 ;E极中H+反应了,促进了水的电离,E极附近溶液中有OH-剩余,所余OH-遇酚酞变红
;E极中H+反应了,促进了水的电离,E极附近溶液中有OH-剩余,所余OH-遇酚酞变红
15.
 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2 被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
答案:BD
14.下列各种方法中:①金属表面涂抹油漆,②改变金属的内部结构,③保持金属表面清洁干燥,④在金属表面进行电镀,⑤使金属表面形成致密的氧化物薄膜。能对金属起到防止或减缓腐蚀作用的措施是
( )
A.①②③④ B.①③④⑤
C.①②④⑤ D.全部
答案:D
13.右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是
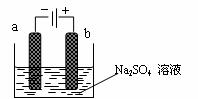
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
答案:D
12.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,下列说法正确的是
CoO2+LiC6,下列说法正确的是
A.充电时,电池的负极反应为LiC6-e- = Li++C6
B.放电时,电池的正极反应为CoO2+Li++e- = LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
答案:B
11.据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池 (PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂为电极,导电离子是H+。下列对该燃料电池的描述正确的是
①正极反应为:O2+4H++4e-= 2H2O ②电子由负极流向正极
③总的化学反应为:2H2+O2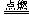 2H2O ④氢离子通过电解质向正极移动
2H2O ④氢离子通过电解质向正极移动
A.①②③ B.②③④ C.①②④ D.①②③④
答案:C
10.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e- + 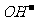 ==
NiOOH + H2O
==
NiOOH + H2O
B.充电过程是化学能转化为电能的过程
 C.放电时负极附近溶液的碱性不变
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的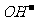 向正极移动
向正极移动
 答案:A
答案:A
9.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
答案:CD
8.关于铅蓄电池的说法正确的是
A.在放电时,正极发生的反应是 Pb(s) +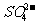 (aq)= PbSO4(s) +2e-
(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e-= Pb(s)+ 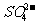 (aq)
(aq)
答案:B
7.下列有关金属腐蚀与防护的说法正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
答案:AC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com