
5.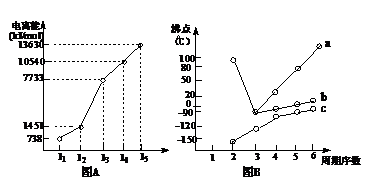 (广东省佛山市禅城实验高中2009届高三第二次月考)(10分)(1)I.短周期某主族
(广东省佛山市禅城实验高中2009届高三第二次月考)(10分)(1)I.短周期某主族

 元素M的电离能情况如右
元素M的电离能情况如右
图(A)所示。则M元素
位于周期表的第 族。
II.图B折线c可以
表达出第 族元素氢
化物的沸点的变化规律。两
位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:
(填“a”或“b”);部分有机物的熔沸点见下表:
|
烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
硝基苯酚 |
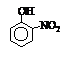 |
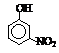 |
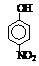 |
|
沸点/℃ |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
由这些数据你能得出的结论是(至少写2条): ,
。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有
(填字母):a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(3)金属是钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
 答案 (1)(5分)I.ⅡA (1分) II.IVA (1分) b(1分) 有机物分子量越大、分子间作用力越强,故沸点越高(1分);当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(1分);当分子间能形成氢键时,分子间作用力增强,熔点升高(1分)。[第一条必须写到,正确给1分;后2条任意写到1条均可,共2分]
答案 (1)(5分)I.ⅡA (1分) II.IVA (1分) b(1分) 有机物分子量越大、分子间作用力越强,故沸点越高(1分);当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(1分);当分子间能形成氢键时,分子间作用力增强,熔点升高(1分)。[第一条必须写到,正确给1分;后2条任意写到1条均可,共2分]
(2)(2分)sp2 c
(3)(3分)I.3d24S2 (1分) II.[TiCl(H2O)5]Cl2·H2O(2分)
4. (广东省汕头金山中学2009届高三化学期中考试)(10分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是 (填编号)
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是 (写分子式)。元素⑨和⑩形成的化合物的化学式为 ,它是一种重要的结构材料,推测它应是属于 晶体;元素①的原子价电子排布式是 。
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5 °。三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是
键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是
(填分子式)。
(4)③和⑨两元素比较,非金属性较弱的是 (填名称),可以验证你的结论的是下列中的 (填序号)。
A、气态氢化物的挥发性和稳定性 B、单质分子中的键能 C、两元素的电负性
D、含氧酸的酸性 E、氢化物中X-H键的键长(X代表③和⑨两元素)
F、两单质在自然界的存在形式
答案.(10分)(1)②(2)PCl3、CCl4 ;Si3N4,原子;3s23p4。(3)π;SO2(4)氮;CE(2分)
3.(广东省汕头金山中学2009届高三化学期中考试)氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是(CD )
A.氯化硼液态时能导电而固态时不导电 B.氯化硼加到水中使溶液的pH升高
C.氯化硼分子呈正三角形,属非极性分子 D.氯化硼遇水蒸气会产生白雾
2、(广东广州花都区2009届高三期初调研试题化学卷)(10分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
答案(共10分)
(1) 1s22s22p4 (2分) σ (2分)
(2)二 IVA 非极性 原子 (4分)
(3) O>P>Si>Li (2分)
1、(广东广州花都区2009届高三期初调研试题化学卷) 2H、13C、15N、18O、34S等常用做环境分析指示物,下列对它们的说法正确的是( B)
A.34S原子核内的中子数为16 B.16O与 18O互称同位素
C.13C和15N原子核内的质子数相差2 D.2H的核外电子数比1H多一个
3.溶液pH的计算
(1)单一溶液的pH计算
①强酸溶液,如HnA,设浓度为c mol·L-1,
c(H+)=nc mol·L-1,pH=-lgc(H+)=-lgnc。
②强碱溶液,如 B(OH)n,设浓度为c mol·L-1,
c(H+)=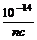 mol·L-1,pH=-lgc(H+)=14+lgnc。
mol·L-1,pH=-lgc(H+)=14+lgnc。
(2)酸、碱混合pH计算
①两强酸混合c混(H+)=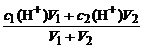
②两强碱混合c混(OH-)=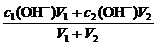
③强酸与强碱混合
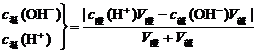
(3)混合溶液pH的计算
①两种pH不同的强酸溶液混合时,要先求出混合后溶液中c(H+),再求其pH,当等体积混合时,可用速算法,即
ΔpH=1时,pH合=pH小+0.26
ΔpH≥2时,pH合=pH小+0.3
②两种强碱的稀溶液混合时,必须先求出混合后溶液中c(OH-),再利用KW换算成c(H+)求其pH。
当等体积混合时也可用速算法:
ΔpH=1时,pH合=pH大-0.26
ΔpH≥2时,pH合=pH大-0.3
(4)稀强酸与稀强碱溶液混合后pH的计算,要先根据H++OH-==== H2O计算出哪种物质过量,然后计算出过量的c(H+)或c(OH-),再求其pH。
(5)pH之和等于14的两种溶液以等体积相混合时,其混合溶液的pH的判断:
①若两者都是强电解质,则混合后pH=7。
②若酸为强酸,碱为弱碱,则混合后pH>7。
③若酸为弱酸,碱为强碱,则混合后pH<7。
(6)等物质的量浓度的一元酸、碱等体积混合后溶液的pH的判断:
①强酸和强碱混合,pH=7;②强酸和弱碱混合,pH<7;③弱酸和强碱混合,pH>7;④弱酸和弱碱混合,pH由强者决定;⑤未注明酸、碱强弱时,pH无法判断。
(7)等体积强酸(pH1)和强碱(pH2)混合:
①若溶液呈中性,二者pH之和为14。
②若溶液呈碱性,二者pH之和大于14。
③若溶液呈酸性,二者pH之和小于14。
试题枚举
[例1]体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0 B.9.5 C.10.5 D.11.0
解析: 方法一:盐酸与某一元强碱恰好完全反应时:n(OH-)=n(H+)。所以有c(OH-)×10V=c(H+)·V,c(OH-)=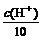 ,c(OH-)=
,c(OH-)=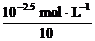 =10-3.5 mol·L-1
=10-3.5 mol·L-1
pH=-lgc(H+)=-lg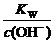 =-lg
=-lg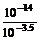 =-lg10-10.5=10.5。所以选择C选项。
=-lg10-10.5=10.5。所以选择C选项。
方法二:若1体积pH=2.5的盐酸和1体积某浓度的该一元强碱恰好完全反应,则酸中H+浓度等于碱中OH上标-浓度,两者的pH之和等于14,也就是碱的pH=11.5。将该溶液稀释10倍,就得到题中所用的强碱溶液,其pH减小1,等于10.5。
答案: C。
[例2] 25 ℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5 b。请填写下列空白。
(1)a值可否等于3(填“可”或“否”)_______,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)_______,其理由是__________________。
(3)a的取值范围是__________________。
解析:本题是对强酸、强碱中和规律的研究,综合性较强。强酸与强碱完全中和,pH之和必为14,即a+b=14,由此可知a=3或a=5均不合题意。难点在a的取值范围的确定上。
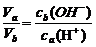 =
=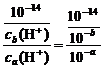 =10a+b-14<1
=10a+b-14<1
所以a+b-14<0,而a=0.5b,即3a<14,a<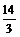 。
。
又pH=b=2a>7,a>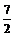 ,所以
,所以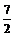 <a<
<a<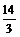 。
。
答案:(1)否 若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
(2)否 若a=5,ca(H+)=10-5 mol·L-1,则b=10,cb(OH-)=10-4 mol·L-1,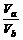 =
=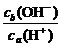 >1,不符合题意,故a≠5
>1,不符合题意,故a≠5
(3)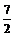 <a<
<a<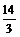
[例3]在pH都等于9的NaOH溶液和CH3COONa溶液中,设由水电离产生的OH-离子浓度分别为Amol/L和Bmol/Lmol则A和B的关系是
A. 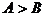 B.
B.
C.  D.
D.

解析:本题是在纯水中加入碱和盐溶液后判断水的电离情况。的NaOH溶液中,,而NaOH只提供OH-,不提供H+,所以溶液中的H+就是水提供的,。
pH=9的CH3COONa溶液中,,由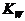 知,
知,
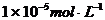 ,CH3COONa不提供H+和OH-
,CH3COONa不提供H+和OH-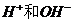 ,两者全部来自于水的电离。,所以答案为B。应指出的是,这里的
,两者全部来自于水的电离。,所以答案为B。应指出的是,这里的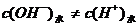 ,因水电离出来的
,因水电离出来的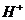 有相当一部分转化为CH3COOH了,=
有相当一部分转化为CH3COOH了,=
。 本题也可以根据“酸碱抑制,盐促进”来估算,立即得答案为B。
答案:B
[例4] 常温下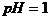 的两种一元酸溶液A和B,分别加水1000倍稀释,其pH与所加水的体积变化如下图所示,则下列结论中正确的是
的两种一元酸溶液A和B,分别加水1000倍稀释,其pH与所加水的体积变化如下图所示,则下列结论中正确的是
A. A酸比B酸的电离程度小 B. B酸比A酸容易电离
C. B是弱酸,A是强酸 D. pH=1时,B酸的物质的量浓度比A酸大
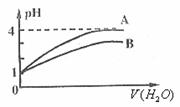 解析:如果一元酸是强酸,pH=1时,
解析:如果一元酸是强酸,pH=1时,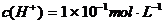 ,加水稀释103倍后,此时,,
,加水稀释103倍后,此时,,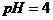 。如果是一元弱酸,则
。如果是一元弱酸,则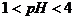 。从图上可以看出A酸为强酸而B酸是弱酸。pH=1时,B酸的物质的量浓度比A酸大。所以C和D是正确的。
。从图上可以看出A酸为强酸而B酸是弱酸。pH=1时,B酸的物质的量浓度比A酸大。所以C和D是正确的。
答案:CD
2.溶液酸碱性的基本规律
(1)溶液酸碱性判定规律
①pH相同的酸,酸越弱,酸物质的量浓度越大;pH相同的碱,碱越弱,碱物质的量浓度越大。
②酸与碱的pH之和为14,且等体积混合时,强酸与强碱混合,pH=7;强酸与弱碱混合,pH>7;强碱与弱酸混合,pH<7。
(2)稀释后溶液pH的变化规律
①对于强酸溶液,每稀释10n倍,pH增大n个单位(增大后不超过7)。
②对于强碱溶液,每稀释10n倍,pH减小n个单位(减小后不小于7)。
③对于pH相同的强酸与弱酸(或强碱与弱碱)稀释相同倍数时,pH变化不同,其结果是强酸或强碱的变化的程度大。
④对于物质的量浓度相同的强酸和弱酸,稀释相同倍数,pH变化不同,其结果是强酸稀释后pH增大得比弱酸快(强碱、弱碱类似)。
1.水的电离和影响因素
⑴水是一个极弱的电解质,存在电离平衡:
H2O H++OH-
H++OH-
(2)影响水电离平衡的因素
①酸、碱
在纯水中加入酸或碱,均使水的电离平衡左移,此时若温度不变,KW不变,c(H+)发生改变,pH也随之改变;若向水中加入酸,则c(H+)增大,c(OH-)变小,pH变小。
②温度
若升温,由于水电离吸热,升温将促进水的电离,故平衡右移,c(H+)、c(OH-)同时增大,pH变小,但由于c(H+)与c(OH-)始终保持相等,故仍显中性。
③易水解的盐
在纯水中加入能水解的盐,不管水解后溶液显什么性,均促进水的电离,使水的电离程度增大,但只要温度不变,KW不变。
④其他因素
如向水中加入活泼金属,由于与水电离出的H+直接作用,因而促进了水的电离平衡向电离的方向移动。
3.酸、碱批示剂及溶液pH值的实验测定方法
⑴常用指示剂及变色范围
|
指示剂 |
变色范围 |
|
甲基橙 |
|
|
酚酞 |
|
|
石蕊 |
|
⑵测定溶液pH值方法:
精确方法:pH计法
常用方法:pH试纸法 。不能先用水湿润pH试纸的原因是 。
2.溶液的酸碱性和pH值
⑴溶液的酸碱性:25°C时:中性溶液c(H+)=c(OH-)= pH= ;酸性溶液 ;碱性溶液 ;溶液的酸碱性与溶液PH值是否等于7 (填有关或无关),与溶液中c(H+)和c(OH-)的 有关。
⑵溶液的pH值:
①概念: 。
②表达式: ,pH值适合于表示 溶液的酸碱性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com