
4. (08山东临沂质量检测一)一定温度下,在体积为 VL
的密闭容器中加入1molX和1molY进行如下反应:X(g) + Y(g )  2Z(g )+
W(s) △H >0达到平衡,下列判断正确的是
2Z(g )+
W(s) △H >0达到平衡,下列判断正确的是
A. 向平衡混合物中加入少量W, 正、逆反应速率均增大
B. 平衡后加入X,上述反应的△H增大
C. 温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2
D. 当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
 5.(08山东省威海市08质量检测)在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法不正确的是 (
A )
5.(08山东省威海市08质量检测)在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法不正确的是 (
A )
A.2min时,M的物质的量浓度为0.6mol·L-1
B.4min时,用M表示的反应速率为0.2mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量不变
D.4min时,M的转化率为80%
3.(08山东省沂水三中第二次诊断性)(8分)将2mol I2(g)和1mol H2置于某2L密闭容器中,在一定温度下发生反应:

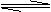 I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(Ⅱ)所示。
I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(Ⅱ)所示。
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下ω(HI)的变化如图曲线(Ⅰ)所示,在乙条件下
ω(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
答案 (1)0.55mol·L-1 (2)③⑤ ① (3)4b+c=2a
2.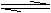 (08山东省沂水三中第二次诊断性)右图表示可逆反应A(s)+B(g) nC(g);△H=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是
(08山东省沂水三中第二次诊断性)右图表示可逆反应A(s)+B(g) nC(g);△H=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是
 ( D
)
( D
)
A.若条件为催化剂,则a表示有催化剂,b表示没
有催化剂
B.只控制温度,则a比b的温度高,△H>0
C.只控制压强,则a比b的压强大,n>2
D.由图象可以作出判断,反应一定从正反应方向开始
1. (08山东省淄博高三模拟)(14分)已知反应:N2(g)+3H2(g) 2NH3(g)
(08山东省淄博高三模拟)(14分)已知反应:N2(g)+3H2(g) 2NH3(g) 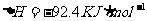 。
。
(1)在一定条件下,向一密闭容器中充入1molN2和3molH2,充分反应后放出的热量
(填“<”“>”“=”)92.4KJ,理由是 。
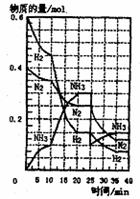 (2)在500℃、200atm和铁催化条件下,将H2和N2通入固定容积为1L的恒温密闭容器中发生反应,反应过程中H2、N2和NH3物质的
(2)在500℃、200atm和铁催化条件下,将H2和N2通入固定容积为1L的恒温密闭容器中发生反应,反应过程中H2、N2和NH3物质的
量变化如图所示,根据题完成下列各问:
①反应达到平衡时,平衡常数K= ,
此时增加N2的量,平衡常数将 。
②反应进行到20min时,N2的平均反应速率为
。
③据图判断,反应进行到10min至20min时曲线发
生变化的原因是 ;
反应进行至25min时,曲线发生变化的原顺是
。
(3)①若在上述(2)条件下,向容器中通入a molN2与b molH2的混合气体,当反应达到平衡时,测得n(N2)=c mol,n(NH3)=d mol,则a= (用含其它字母的关系式表示)。
②若在上述相同温度和催化剂的条件下,向一个初始容积仍为1L的,但容积可变、能保持恒压(200 atm)的密闭容器中通入a mol N2与b mol H2的混合气体,反应达平衡时生成NH3 e mol,则d与e比较 (填编号)
A.d<e B.d>e C.d=e D.不能比较
作出此判断的理由是 。
答案(1)<(1分) 由于该反映是可逆反应,1molN2和3molH2不能完全反应生成2molNH3,因此反应放出的热量少于92.4kJ。(2分)
(2)①320/3 (1分) 不变 (1分) ②0.0075mol/(L·min) (1分)
③加入催化剂 (2分) 移去0.2molNH3(或使0.2molNH3液化 (2分)
(3)①c+(d/2)或(2c+d)/2(1分)
② A (1分) 因为保持容器不变时比保持容器的容积可变(恒压)体系的压强小,当压强减小时有利于逆向反应,故反应达到平衡后生成氨气的物质的量减小,因此c>d。
(2分)
25. (海州高级中学2009届高三化学第三次综合测试)(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
(海州高级中学2009届高三化学第三次综合测试)(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
 ⑴卤素互化物BrCl能发生下列反应
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
KBr+BrCl===KCl+Br2
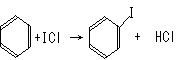
①写出KI与IBr反应的化学方程式_____________ _。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式________________________。
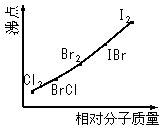
⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________________________________________。
⑶试推测ICl的沸点所处的最小范围_____________________________________________。
答案.(1)①KI+IBr==KBr+I2
②C6H6+ICl→C6H5I+HCl;或
(2)相对分子质量越大,分子间作用力越强
(3)介于Br2的沸点和IBr的沸点之间
24.(江苏省宿迁中学高三实验班化学模拟2)(10分)乙基香草醛(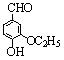 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中两种含氧官能团的名称_______________________。
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
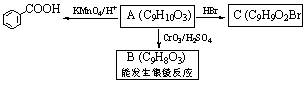
提示:①RCH2OH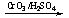 RCHO;
RCHO;
②与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
(a)由A→C的反应属于_______________(填反应类型)。
(b)写出A的结构简式________________________。
(3)乙基香草醛的另一种同分异构体D(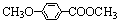 )是一种医药中间体。请设计合理方案用茴香醛(
)是一种医药中间体。请设计合理方案用茴香醛(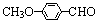 )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。 例如:
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。 例如: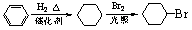
答案 (10分)(1)醛基、(酚)羟基、醚键。(3分)
(2)(a)取代反应。(2分)(b)
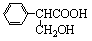 。 (2分)
。 (2分)
(3)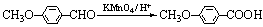
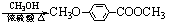 (3分)
(3分)
23、(江苏省宿迁中学高三实验班化学模拟2)(12分)实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出)。请回答有关问题:
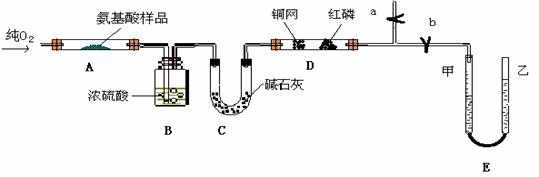
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的
目的是 ,之后关闭止水夹a。
(2)由装置B、C可分别确定待测氨基酸中含有的 和 质量。
(3)E装置的作用是测量 的体积,并由此确定待测氨基酸中含有的
的质量,为了较准确地测量该气体的体积。在读反应前后甲管中液面的读数求其差值
的过程中,应注意 (填代号)。
a、视线与凹液面最低处相平 b、等待片刻,待乙管中液面不再上升时,立刻读数
c、读数时应上下移动乙管,使甲、乙两管液面相平
d、读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确
其理由是
(5)严格地说,按上述方案只能确定氨基酸的 。
若要确定此氨基酸的分子式,还要测定该氨基酸的 。
答案(1)排净装置中的N2 (2)H元素;C元素
(3)N2;N元素; ac (4)N2的体积; 多余的O2在D中没有被吸收完全
(5)最简式; 相对分子质量
22.(江苏省宿迁中学高三实验班化学模拟2)茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:
关于茉莉醛的下列叙述不正确的是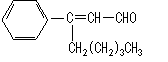
A.茉莉醛与苯甲醛互为同系物
B.在加热和催化剂作用下,能被氢气还原生成一种芳香醇
C.一定条件下,能被银氨溶液、新制氢氧化铜等多种氧化剂氧化
D.能与氢溴酸发生加成反应
21.(江苏省宿迁中学高三实验班化学模拟2)微观粒子是化学研究的主要对象。若阿伏加德罗常数为6.02×1023mol-1,下列对粒子数判断正确的是
A.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数为0.7×6.02×1023

 B.2.8g [CH2-CH2 ]n 中含有的碳原子数为0.2×6.02×1023
B.2.8g [CH2-CH2 ]n 中含有的碳原子数为0.2×6.02×1023
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023
D.标准状况下,22.4LCH4和CH2Cl2的混合物所含有的分子数目为6.02×1023
20.(江苏省华罗庚中学2009届年秋学期高三年级第三次教学质量检测)物质间某些方面存在相似性的同时还存在某些性质的递变性,下列说法正确的是[C]
A.HClO4、H2SO4、H3PO4的酸性逐渐增强
B.等质量的甲烷、乙烯、乙炔充分燃烧,消耗氧气的量由少到多
C.CH3CH2OH、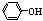 、CH3COOH电离出H+的能力由弱到强
、CH3COOH电离出H+的能力由弱到强
D.物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH由小到大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com