
4.若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存.
如:Ba2+、Ca2+与CO32-、SO32-、PO43-、SO42-等;Ag+与Cl-、Br-、I- 等;Ca2+与F-,C2O42- 等
3.弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存.它们遇强酸(H+)会生成弱酸分子;遇强碱(OH-)生成正盐和水. 如:HSO3-、HCO3-、HS-、H2PO4-、HPO42-等
2.弱酸阴离子只存在于碱性溶液中。如CH3COO-、F-、CO32-、SO32-、S2-、PO43-、 AlO2-均与H+不能大量共存.
1.弱碱阳离子只存在于酸性较强的溶液中.如Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH-不能大量共存.
15、6FeBr2+3Cl2(不足)==4FeBr3+2FeCl3 2FeBr2+3Cl2(过量)==2Br2+2FeCl3
八、离子共存问题
离子在溶液中能否大量共存,涉及到离子的性质及溶液酸碱性等综合知识。凡能使溶液中因反应发生使有关离子浓度显著改变的均不能大量共存。如生成难溶、难电离、气体物质或能转变成其它种类的离子(包括氧化一还原反应).
一般可从以下几方面考虑
14、C2H5Cl+NaOH C2H5OH+NaCl C2H5Cl+NaOHCH2=CH2↑+NaCl+H2O

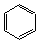 +3Cl2 (六氯环已烷)
+3Cl2 (六氯环已烷)

 13、 + Cl2 + HCl
13、 + Cl2 + HCl
10、Fe+6HNO3(热、浓)Fe(NO3)3+3NO2↑+3H2O
Fe+4HNO3(热、浓)Fe(NO3)2+2NO2↑+2H2O
|