
4.科学家于1995年合成了一种化学式为C200H200含有多个C≡C (碳碳叁键)的链状烃,其分子中含有C≡C最多是
A.49个 B.50个
C.51个 D.无法确定?
3.实验室制取下列气体的方法正确的是?
A.氨:将消石灰和氯化铵加热,并用向下排空气法收集?
B.乙炔:将电石和水在启普发生器中反应,并用向上排空气法收集?
C.乙烯:将乙醇加热至
D.硫化氢:用硫化亚铁与稀盐酸反应,并用向下排空气法收集?
2.燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量的丙烯所产生的CO2的质量,该混合气体是?
A.丁烯、丙烷 B.乙炔、乙烯?
C.乙炔、丙烷 D.乙烷、环丙烷?
1.(2001年高考理综题)具有单双键交替长链(如:…―CH==CH―CH==CH―CH==CH―…)的高分子有可能成为导电塑料。2000年诺贝尔(Nobel)化学奖即授予开辟此领域的3位科学家。下列高分子中可能成为导电塑料的是?
A.聚乙烯 B.聚丁二烯?
C.聚苯乙烯 D.聚乙炔?
(2)产生 太多,超过B的容积而无法测定
太多,超过B的容积而无法测定 的体积;生成
的体积;生成 太少,测出的
太少,测出的 体积值太小,误差太大;0.60。
体积值太小,误差太大;0.60。
(3)轻轻旋开活塞,使水缓慢地滴下,直到不再产生气体时关闭活塞。
(4)286V/W。
4.实战演练
(1) ;B贮水,以使烧瓶A中产生的
;B贮水,以使烧瓶A中产生的 进入B时,排出与它等体积的水进入量筒。C测定乙炔的体积;防止电石与残留的水或水汽作用产生的乙炔逸散到大气中。
进入B时,排出与它等体积的水进入量筒。C测定乙炔的体积;防止电石与残留的水或水汽作用产生的乙炔逸散到大气中。
(2)所用电石质量不能太大,否则________;也不能太小,否则________;若容器B的容积为250 mL,则所用电石的质量应在________g左右(从后面数据中选填:0.03,0.60,1.00,1.50,2.00)。
(3)分液漏斗往烧瓶里滴加水的操作方法是________。
(4)实验中测得排入量筒中水的体积为V L、电石的质量为W g。则电石中碳化钙的质量分数是________%(不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计)。
解析:本题必须弄清测定电石中碳化钙质量分数的原理:它是利用测量量筒中水的体积来测量乙炔气体之体积,再由乙炔气体体积来计算碳化钙的质量分数。因此在量筒前的装置都必须密闭,产生乙炔的量不能超过B瓶中水的体积,也不能使流入量筒的水太小,否则会导致实验失败。
答案:
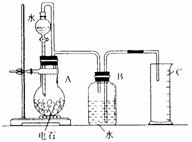
图1
(1)烧瓶中发生反应的化学方程式为_______;装置B、C的作用是_______;烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了_______。
答案: ,
, ,
, ;凡分子里氢原子个数为4的气态烃,完全燃烧前后气体总物质的量不变,若温度高于
;凡分子里氢原子个数为4的气态烃,完全燃烧前后气体总物质的量不变,若温度高于 的密闭容器中,定温时,其压强不变。
的密闭容器中,定温时,其压强不变。
[例3] 某同学设计了如图1所示的实验装置来粗略地测定电石中碳化钙的质量分数。
解析:因为1个碳原子转变为 时需要1分子
时需要1分子 ,4个氢原子转变为2分子
,4个氢原子转变为2分子 时也需要1分子
时也需要1分子 ,通过烃的分子式就可以确定需要的
,通过烃的分子式就可以确定需要的 的量和生成的
的量和生成的 与
与 的量,再根据阿佛加德罗定律即可求解。
的量,再根据阿佛加德罗定律即可求解。 ,需
,需 ,生成
,生成 、
、
 ,容器内气体压强不变。
,容器内气体压强不变。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com