
3、“神州二号”无人飞船运行的周期和飞行的速度约为…………………………( )
A. 80min 7×103m/s B. 90min 7.7×103m/s
C. 85min 7.9×103m/s D. 24h 7.9×103m/s
2、某人造地球卫星因受到高空稀薄空气的阻力作用,绕地球运转的轨道会慢慢改变,每次测量中卫星的运动可以近似看作圆周运动,某次测量卫星的轨道半径为r1,后来变为r2且r2> r1,以EK1、EK2表示卫星在这两个轨道上的动能,T1、T2表示卫星在这两个轨道上绕地球运动的周期,则………………………………………………………………( )
A. EK1>EK2 T1>T2 B. EK1<EK2 T1<T2
C. EK1<EK2 T1>T2 D. EK1>EK2 T1<T2
1、地球上有两位相距非常远的天文观测者,在夜晚都发现自己正上方有一颗人造地球卫星相对自己静止不动,则这两位观测者的位置及两颗人造地球卫星到地球的距离可能是( )
A. 一人在南极另一个人在北极,两卫星到地球中心的距离一定相等
B. 一人在南极另一个人在北极,两卫星到地球中心的距离成整数倍
C. 两个人都在赤道上,两卫星到地球中心的距离一定相等
D. 两个人都在赤道上,两卫星到地球中心的距离可以不相等
2.030 lg(c0/c)=kt1/2(t1/2=5700年)
k=1.216×10-4年-1,根据14C浓度变化可得:2.303 lg(c0/c)=1.216×10-4t,c0=1.10×
10-13%;c=9.87×10-15%。代入上式得:t=19831年。
4.确定一定质量的某种离子中所含某一基本粒子(如电子)的数目,此类问题具有一定的综合性,常用到有关物质的量的计算。
考查原子结构的试题大多以选择题形式出现,模式也较为稳定。由于原子结构的发现源于物理学中α粒子的运动实验,无疑,原子结构成了理化学科间综合的素材。预计这一知识会成为“3+X”综合测试命题的依据。
[例题]同位素概念是1913年由英国科学家索迪(1877~1956年)提出的。同位素虽然质量数不同,但它们的化学性质几乎完全相同。在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的。同位素原子在许多方面有着广泛的应用。回答下列问题:
(1)1934年,科学家在用α粒子轰击铝箔时,除探测到预料中的中子外,还探测到了正电子,更意外的是,拿走α放射源后,铝箔虽不再发射中子,但仍断续发射正电子,而且这种放射性随时间衰减的规律跟天然放射性一样,也有一定的半衰期。
①写出α粒子轰击铝箔(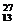 Al)产生中子的核反应方程式,并比较与普通的化学方程式的本质区别。
Al)产生中子的核反应方程式,并比较与普通的化学方程式的本质区别。
②上述产生的具有放射性的同位素叫作放射性同位素,写出其产生正电子的核反应方程式。
③简要说明放射性同位素的应用。并至少举出两个实际应用的例子。
(2)已知硼元素有两种同位素,分别为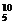 B和
B和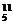 B,硼元素的相对原子质量为10.8,计算
B,硼元素的相对原子质量为10.8,计算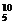 B占硼元素的质量分数。
B占硼元素的质量分数。
(3)①用CH3COOH与H18OC2H5在酸催化下发生酯化反应,18O最后存在于哪种产物中?
②在2SO2+O2 2SO3的可逆反应达平衡后,充入18O2,问过一段时间重新建立平衡后,18O存在于哪些物质中?
2SO3的可逆反应达平衡后,充入18O2,问过一段时间重新建立平衡后,18O存在于哪些物质中?
(4)用32P标记噬菌体的DNA,侵染细菌后32P可出现在
A.噬菌体残留的外壳内 B.细菌的残体内
C.全部子代噬菌体内 D.极少数子代噬菌体内
(5)现有从生物体内提取的一个DNA分子和标记了放射性同位素3H的四种脱氧核苷酸,要在实验室合成新的DNA分子。
①合成新的DNA分子除需上述物质外,还需要 和 等。
②在合成的两个子代的DNA分子中,每个DNA都含有 条含有3H的脱氧核苷酸链。
(6)放射性同位素的蜕变反应速率为:2.303 lg(c0/c)=kt[其中:c0为放射性物质的初浓度,c为某一指定时刻的浓度,t为反应所经历的时间,k为速率常数,单位为(时间)-1]。在蜕变反应中,反应物消耗一半(或反应物浓度减少到初浓度的一半)所需要的时间称为半衰期,利用放射性元素的半衰期可以确定岩石、古代动植物化石的“年龄”。
碳的放射性同位素14C在自然界树木中的分布基本保持在总碳量的1.10×10-13%。某考古队在一山洞中发现一些古代木头燃烧的灰烬,经分析14C的含量为总碳量的9.87×10-15%,已知14C半衰期为5700年,试计算该灰烬距今约为多少年?
解答:本综合题横跨化学、物理、生物三个学科。涉及到核物理和同位素知识,而半衰期知识则为新信息,运用于古代动植物的年龄测定。
(1)①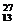 Al+
Al+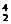 He
He
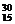 P+
P+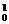 n 与普通化学方程式的区别是:普通化学反应原子核不变,而核反应过程中原子核发生了变化,②
n 与普通化学方程式的区别是:普通化学反应原子核不变,而核反应过程中原子核发生了变化,②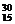 P
P
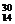 Si+
Si+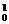 e,③放射性同位素的应用主要分两类:一是利用它的射线,二是做示踪原子,例如:利用钴-60放出的很强的γ射线来检查金属内部有没有砂眼或裂纹,这叫γ射线探伤。农业施肥中在肥料中加一些放射性同位素,就会知道哪种农作物在什么季节最能吸收含哪种元素的肥料。另外在生物学研究方面,同位素示踪技术也起着十分重要的作用;
e,③放射性同位素的应用主要分两类:一是利用它的射线,二是做示踪原子,例如:利用钴-60放出的很强的γ射线来检查金属内部有没有砂眼或裂纹,这叫γ射线探伤。农业施肥中在肥料中加一些放射性同位素,就会知道哪种农作物在什么季节最能吸收含哪种元素的肥料。另外在生物学研究方面,同位素示踪技术也起着十分重要的作用;
(2)0.2;(3)①18O存在于酯中,②18O存在于所有的物质中;(4)D;(5)①磷酸,含氮碱基
②1(每个DNA分子中,只有做模板的母链上有3H,子链上没有)
(6)解:由半衰期求t,当c=c0/2时,t/t1/2。代入速率方程:
3.同位素的概念及应用。要注意理解有关概念的内涵和外延,并能区分易混淆的概念如同素异形体、同分异构体等。
2.注重对电性关系的考查。依据是:中性原子中,核外电子数=质子数;阳离子中,核外电子数<质子数;阴离子中,核外电子数>质子数。此类题目有一定的难度,解题时要注意方法技巧。
原子结构和同位素的考查,常以重大科技成果为知识背景,寓教于考,突出教育性与实践性,常考的热点有:
1.关于原子的组成及各基本粒子之间的关系,即质量数=中子数+质子数。常常结合新发现的元素或同位素来考查,题目翻新,但题型不变,考查的知识点不变。
3.核外电子数相同的粒子规律
(1)核外电子总数为10个电子的粒子共有15种。阳离子有:Na+,Mg2+,Al3+,NH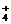 ,H3O+;阴离子有:N3-,O2-,F-,OH-,NH
,H3O+;阴离子有:N3-,O2-,F-,OH-,NH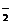 ;分子有:Ne,HF,H2O,NH3,CH4。
;分子有:Ne,HF,H2O,NH3,CH4。
(2)核外电子总数为18个电子的粒子共有16种。阳离子有K+,Ca2+,阴离子有P3-,
S2-,HS-,Cl-;分子有Ar,HCl,H2S,PH3,SiH4,F2,H2O2,C2H6,CH3OH,N2H4。
(3)核外电子总数及质子总数均相同的离子有:Na+,NH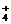 ,H3O+(或F-,OH-,NH
,H3O+(或F-,OH-,NH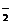 )。
)。
2.元素的原子半径、离子半径大小比较规律
(1)同周期原子半径随原子序数递增逐渐减小(稀有气体元素除外)。如第三周期中:Na>Mg>Al>Si>P>S>Cl
(2)同主族原子半径随原子序数的递增逐渐增大。如第ⅠA族中:Li<Na<K<Rb<Cs
(3)同周期阳离子半径随原子序数递增逐渐减小。如第三周期中:Na+>Mg2+>Al3+
(4)同周期阴离子半径随原子序数递增逐渐减小。如第三周期中:P3->S2->Cl-
(5)同主族阳离子半径随原子序数递增逐渐增大。如第ⅠA族中:Na+<K+<Rb+<Cs+
(6)同主族阴离子半径随原子序数递增逐渐增大。如第Ⅶ族中:F-<Cl-<Br-<I-
(7)阳离子半径总比相应原子半径小。如:Na+<Na,Fe2+<Fe
(8)阴离子半径总比相应原子半径大。如:S2->S,Br->Br
(9)电子层结构相同的离子半径随核电荷数的增大而减小。如:S2->Cl->K+>Ca2+,
Al3+<Mg2+<Na+<F-
(10)同一元素不同价态的离子半径,价态越高则离子半径越小。如:Fe>Fe2+>Fe3+,
H->H>H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com