
18.答案:D
解析:A组K、Na原子序数差为8,分别失一个电子后,仍不等;B组分子中都含2个氧原子,但C、N电子数不等,故分子的电子总数不等;C组分子相差一个氧原子也不等,故选D。注意计算分子的电子总数不必看成键情况,无论得失还是共用电子,都在分子内,所以直接按分子中原子的电子数之和计算即可。
17.答案:A
解析:依据质量数=中子数+质子数,Ti的五种同位素的中子数分别为:24、25、26、27、28。
16.答案:B
解析:此题考查了核组成符号中数字的含义和中子数与核外电子数、质量数三者的关系。中子数与核外电子数之差=125-2×53=19。
15.答案:A
解析:此题有多种解法,可用十字交叉法进行计算判断。也可进行更简单的推理判断,假设二者原子个数比为1∶1,则平均相对原子质量应为192,则小于实际的192.2,所以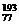 Ir的含量大。只能选A。
Ir的含量大。只能选A。
14.答案:B
解析:此题比较基本,但考查的知识点非常明确:一是原子组成的表示方法即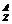 X所代表的意义;二是原子中各粒子间的质量关系,即质量数=质子数+中子数。
X所代表的意义;二是原子中各粒子间的质量关系,即质量数=质子数+中子数。
13.答案:D
解析:质量数=中子数+质子数,由此可得该同位素的质量数=114+184=298。
12.答案:AD
解析:本题用试探法解决比较简便。分子量为70的分子是由两个35Cl原子构成的,分子量为72的是由一个35Cl和一个37Cl原子构成的,分子量为74的分子是由两个37Cl原子构成的,由此可以计算出每个选项中分子数比对应的35Cl与37Cl原子个数比值。分子数为5∶2∶1时:35Cl∶37Cl=(2×5+1×2)∶(1×2+2×1)=3∶1;分子数为5∶2∶2时,35Cl∶37Cl=(2×5+1×2)∶(1×2+2×2)=2∶1,分子数为9∶3∶1时,35Cl∶37Cl=(2×9+1×3)∶(1×3+2×1)=21∶5,分子数为9∶3∶2时,35Cl∶37Cl=(2×9+1×3)∶(1×3+2×2)=3∶1。
11.答案:A
解析:一般情况下,原子半径最大的原子应是电子层数最多的。电子层数相同的原子,即同周期元素的原子,因同周期从左到右原子半径减小,所以最外层电子数最少的原子半径最大。
10.答案:B
解析:质子数+中子数=质量数。中子数为222-86=136,中子数与质子数之差为:136-86=50。
9.答案:A
解析:元素的相对原子质量是各同位素原子相对原子质量的平均值,所以,A正确,B不正确。由相对原子质量的定义可知:设该元素原子的质量为x,则: =m+n,即x=(m+n)w/12;在原子核内,一个中子质量比一个质子的质量略大,且中子数等于或大于质子数,故中子的总质量大于质子的总质量。
=m+n,即x=(m+n)w/12;在原子核内,一个中子质量比一个质子的质量略大,且中子数等于或大于质子数,故中子的总质量大于质子的总质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com