
29.答案:
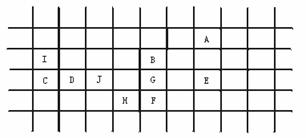
解析:本题考查了元素的性质随着原子序数(题中给元素相对原子质量)的递增而呈现周期性变化这一规律。解题时要充分利用表中数据,结合学习过的元素周期性变化:①同族金属元素(性质相似的金属元素)从上到下,熔点逐渐降低;②同周期的金属元素,从左到右,熔点逐渐升高。解题的方法技巧是:①确定元素种类:B、F、G、H属活泼金属;D、J属不活泼金属;C、I属非金属;A、E属稀有元素。②按元素的相对原子质量由小到大排列一横行;再把同类元素按相对原子质量自上而下排成一纵行;③结合表中已定位的A、B、H元素,确定其他元素的位置。
28.答案:(1)随着原子序数增大,E值变小 周期性
(2)①③ (3)485 738
(4)10号元素为氖。该元素原子的最外层电子排布已达到8电子稳定结构
解析:此题考查了元素第一电离能的变化规律和学生的归纳总结能力。
(1)从H、Li、Na、K等可以看出,同主族元素随元素原子序数的增大,E值变小;H到He、Li到.e、Na到Ar呈现明显的周期性。
(2)从第二、三周期可以看出,第ⅢA和ⅥA族元素比同周期相邻两种元素E值都低。由此可以推测E(砷)>E(硒)、E(溴)>E(硒)。
(3)根据同主族、同周期规律可以推测:E(K)<E(Ca)<E(Mg)。
(4)10号元素是稀有气体氖,该元素原子的最外层电子排布已达到8电子稳定结构。
27.答案:(1)n=2 m=4 (2)a=119
解析: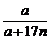 =0.778……①
=0.778……①
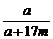 =0.636……②
=0.636……②
由①和②解得n/m=1/2,讨论得n=2 m=4,再把m或n代入①或②得a=119。
26.答案:(1)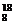 O (2)Ⅷ
(3)17 (4)六
七
O (2)Ⅷ
(3)17 (4)六
七
25.答案:(1)CH4>NH3;H2S>HCl (2)> > (3)CFCl3(或CF3Cl) (4)使大气臭氧层出现空洞 a
解析:此题介绍了致冷剂的使用以及对环境的污染和开发新致冷剂的思路,阅题后感到耳目一新,但此题要考查的知识是非常简单的。(1)联想二周期和三周期元素的氢化物不难填出空格。(2)由题给信息毒性PH3>NH3即同主族元素所形成结构和组成相似的物质,从上而下毒性增大。(3)由CF2Cl2的组成可联想出与它类似的物质,如CF3Cl或CFCl3。(4)氟里昂CF2Cl2这种致冷剂对环境有危害,它可以破坏臭氧层,所以开发新致冷剂要注意这种物质的毒性、沸点、可燃性、以及对环境的危害性等因素。
24.答案:(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH===KCl+KClO+H2O
(3)2KClO3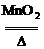 2KCl+3O2↑
2KCl+3O2↑
解析:该题为元素化合物的推断题,在解答有关的推断题时,首先找出突破口,而本题的突破口在②③两步中,由②可知X元素应为非金属(因为有多种价态),又由③可知单质A与强碱液反应,联想Cl2与NaOH的反应,进而确定A单质为Cl2,而X元素为Cl,又因Z元素原子序数大于X,可推知为K元素,又联想KClO3催化分解产物的化学式。
23.答案:D
解析:短周期中符合原子个数比为2∶3的化合物有B2O3、Al2O3、B2S3、Al2S3原子序数差值分别为3、5、11、3;Be3N2、Mg3N2、Be2P3、Mg2P3原子序数之差分别是3、5、11、3;N2O3中原子序数之差为1。
22.答案:CD
解析:X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,则它们的相对位置是X在Y的下一周期,由此对照选项可得解。
21.答案:AC
解析:A,因同周期元素的原子半径从左至右递减,故A对;C,因同主族元素从上至下金属性增强,最高正价氧化物水化物碱性增强,所以C正确。而BeCl2中Be的最外层电子数为2;Mg不与冷水作用,而Be金属性弱于Mg与冷水更难作用。所以B、D不正确。
20.答案:B
解析:元素周期律的发现主要是门捷列夫做的工作。提出原子学说的是卢瑟福,提出分子学说的是阿伏加德罗,发现氧气的是拉瓦锡。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com