
2、焓变、△H的单位,△H的正负号的含义(P3图1-2)
1、有效碰撞、活化分子、活化能、催化剂
30、配位化合物、配位键、配合物的内界、外界、配位数
29、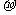 键、
键、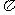 键 (N2、CO2、C2H4分子中含有的化学键)
键 (N2、CO2、C2H4分子中含有的化学键)
28、利用电负性数据判断晶体类型:元素差值 △>1.7 是离子晶体
27、晶格能 晶格能越大,形成的离子晶体越稳定,而且晶体的熔点越高,硬度越大。
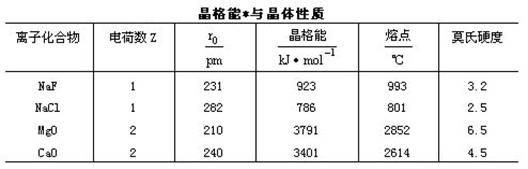
规律:阳离子(阴离子)相同时,阴离子(阳离子)半径越大,晶格能越小。
26、离子晶体 (硬度大、熔沸点高、熔融时能导电。NaCl、CaF2)
25、金属晶体:简单立方(Po型)(配位数4)、钾型(配位数12)、镁型和铜型(配位数12)
24、金属键、用金属键理论解释金属的通性(导电、导热、延展性等)
23、原子晶体(硬度大、熔沸点高):金刚石、硼、硅、锗、二氧化硅、碳化硅、氮化硼
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com