
题目列表(包括答案和解析)
4、在10℃时某化学反应速率为0.1 mol/(L•s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L•s),该反应需在什么温度下进行? ( )
A、30℃ B、40℃ C、50℃ D、60℃
3、在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,若不考虑反应过
程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A、0.02 mol/(L•min) B、1.8mol/(L•min) C、1.2 mol/(L•min) D、0.18 mol/(L•min)
2、在m A + n B  p C的反应中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
( )
p C的反应中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为
( )
A、2:3:2 B、2:3:3 C、1:3:2 D、3:1:2
[例1]一密闭容器内装有N2和H2 ,反应开始时,N2浓度为2 mol/L,H2浓度为5mol/L ,两分钟后,测得N2浓度为1·8mol/L ,则两分钟内N2的平均反应速率是多少?H2和NH3的平均反应速率又分别是多少?通过计算,比较三者速率有何联系?
 [解析]
N2 + 3 H2
[解析]
N2 + 3 H2
 2NH3
2NH3
起始浓度(mol/L) 2 5 0
浓度变化(mol/L) 0·2 0·6 0·4
2 min后浓度(mol/L) 1·8 4·4 0·4 三步分析法
所以:v(N2)=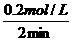 =0·1 mol/(L·min)
=0·1 mol/(L·min)
v(H2)=0·3 mol/(L·min)
v(NH3)=0·2 mol/(L·min)
[随堂检学]
1、下列四种X溶液,均能跟盐酸反应,其中反应最快的是 ( )
A.10℃ 20mL 3mol/L的X溶液 B.20℃ 30mL 2molL的X溶液
C.20℃ 10mL 4mol/L的X溶液 D.10℃ 10mL 2mol/L的X溶液
2.影响化学反应速率的因素:
|
影响化学反应速率的因素 |
规律 |
|
|
内因 |
反应物的性质 |
在其他条件相同时,反应物的化学性质越活泼,化学反应速率越快 |
|
外 因 |
催化剂 |
在其他条件相同时,使用催化剂,化学反应速率加快 |
|
反应物的温度 |
在其他条件相同时,升高反应物的温度,化学反应速率加快 |
|
|
反应物的浓度 |
在其他条件相同时,增大反应物的浓度,化学反应速率加快 |
|
|
气态反应物的压强 |
在其他条件相同时,增大气态反应物的压强,化学反应速率加快 |
|
|
固体反应物的表面积 |
在其他条件相同时,固体反应物的表面积越大,化学反应速率加快 |
|
|
其他 |
光波,电磁波,超声波,溶剂等,也能影响化学反应速率的快慢 |
1.化学反应速率:化学反应速率是用来衡量化学反应快慢程度的物理量,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
⑴表示方法:用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
⑵表达式: 
⑶单位:mol / ( L·s ) mol / ( L·min ) mol / ( L·h )
注 意:
⑴.物质的量浓度可以从溶液中迁移到气体中来。在一定温度下,一定压强下,气体B的物质的量浓度c(B)=n(B)/V
⑵.化学反应速率可以用某一种反应物的浓度的变化表示,也可以用某一种生成物的浓度变化表示。
⑶.由于化学反应中物质的量浓度是随着时间连续不断的变化的。所以化学反应速率有平均速率和瞬时速率之分。在中学化学里,通常所说的化学反应速率是指一段时间内的平均速率,而不是瞬时速率。且均取正值,无负值。
⑷.同一反应选用不同物质浓度的改变量表示速率。数值可能不同,但是表示意义相同。即一种物质的化学反应速率也就代表了整个化学反应的反应速率。
⑸.各物质表示的速率比等于该反应的方程式的化学计量数之比。
⑹.在一定温度下,固体和纯液体物质单位体积内的物质的量保持不变,即物质的量浓度为常数。因此,它们的化学反应速率也被视为常数。由此可见,现在采用的表示化学反应速率的方法还有一定的局限性。
3、知道化学反应的快慢受浓度、温度、压强、催化剂等条件的影响。
2、了解化学反应速率的概念、表达方式及其单位
1、通过实验探究认识不同的化学反应其速率不同
12、在高温、高压和催化剂存在的条件下,把3mol氢气和1mol氮气置于密闭容器中反应能够得到2mol氨气吗?说明理由

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com