
题目列表(包括答案和解析)
5.25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1) ΔH=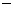 114.6kJ/mol
114.6kJ/mol
B.KOH(aq)+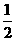 H2 SO4(aq)=
H2 SO4(aq)=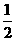 K2SO4(aq)+H2O(l)
ΔH=
K2SO4(aq)+H2O(l)
ΔH=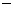 57.3kJ/mol
57.3kJ/mol
C.C8H18(l)+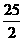 O2(g)=8CO2(g)+9H2O(g) ΔH=
O2(g)=8CO2(g)+9H2O(g) ΔH=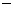 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) ΔH=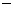 5518 kJ/mol
5518 kJ/mol
4.已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,AgCl转化为AgI,因为AgCl溶解度大于AgI
3.四个试管中都装有5 mL 0.1mol/LNa2S2O3溶液,分别在不同温度下加入0.1mol/L硫酸和一定量水,最先出现浑浊的是
A.40℃,4 mL硫酸,1 mL水 B.20℃,4 mL硫酸,1 mL水
C.40℃,1 mL硫酸,4 mL水 D.20℃,1 mL硫酸, 4 mL水
2.以下说法正确的是
A.不能自发进行的反应属于吸热反应
B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应
C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能
1.下列说法正确的是
A.量筒和滴定管均没有“0”刻度
B.用湿润的pH试纸测NaOH溶液,测得的pH值比实际的大
C.在中和热的测定实验中,由于热量的散失,实际测得的值比理论值57.3 kJ/mol小
D.使甲基橙变黄色的溶液一定显碱性
20.(8分)实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如下图,请回答下列问题:
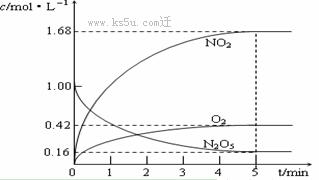
⑴ 该反应的化学方程式为
__________________________ 。
⑵ 0 - 5 min钟内,氧气的平均反应速率v (O2)= 。
⑶ 0-2 min内v (N2O5)明显大于2-5 min内的v(N2O5),原因是 。
⑷ 该反应的平衡常数表达式为
_______________ 。
(六) 问题讨论:
(1)若“实验过程(1)”中用蒸馏水洗涤后,未用标准NaOH溶液润洗,会导致测定结果(填“偏大”、“偏小”或“无影响”)_____________
(2) 步骤“实验过程(2)”中,在锥形瓶装液前,留有少量蒸馏水,测定结果(填“偏大”、“偏小”或“无影响”)____________
19.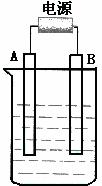 (11分)在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量。请回答下列问题:
(11分)在如图用石墨作电极的电解池中,放入500mLCuSO4溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量。请回答下列问题:
(1)A电极连接的是电源的___________;(填“正极”或“负极”)
 A电极发生反应的电极反应式
A电极发生反应的电极反应式
。
(2)B电极发生反应的电极反应式
。
(3)写出电解时反应的离子方程式
。
(4)电解后溶液的pH变化为 ;(填升高或下降)
要使电解后溶液恢复到电解前的状态,则需加入 物质。(填分子式)
(五) 数据记录与处理(请在下面表格里填上消耗NaOH溶液的平均体积,并计算出盐酸的浓度,填在相应的划线上)。
|
滴定次数 |
盐酸体积mL |
NaOH溶液体积读数(mL) |
消耗NaOH溶液的平均体积(mL) |
|
|
滴定前 |
滴定后 |
|||
|
1 |
20.00 |
0.00 |
16.26 |
|
|
2 |
20.00 |
0.00 |
16.30 |
|
|
3 |
20.00 |
0.02 |
16.24 |
通过计算可得,该盐酸浓度为:____________mol·L-1(计算结果保留2位小数)
(四) 实验过程
(1) 检查滴定管是否漏液,洗涤仪器,润洗后装好标准NaOH溶液待用。
(2) 用 (填仪器名称)向锥形瓶中移入20.00mL待测浓度的盐酸,滴入2滴指示剂。
(3) 排气、调节装标准NaOH溶液滴定管液面至刻度“0”或“0”刻度以下。
(4) 用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化,直到滴定终点。滴定至终点时的现象是 ____________________________。
(三) 实验用品及试剂
(1) 仪器和用品:酸式滴定管、碱式滴定管、锥形瓶、滴定架等
(2) 试剂:浓度0.2000mol·L-1的标准NaOH溶液、酚酞溶液、 蒸馏水等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com