
题目列表(包括答案和解析)
19.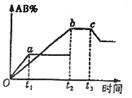 有反应A2+B2
有反应A2+B2  2AB;在温度和压强可变条件下。产物AB
2AB;在温度和压强可变条件下。产物AB
的生成情况如图所示:a为500℃,b为300℃,从t3开始压缩容
器,则下列叙述正确的是
A.AB为气体,A2、B2中必有一种为非气体;正反应吸热
B.AB为气体,A2、B2中必有一种为非气体;正反应放热
C.AB为固体,A2、B2中必有一种为非气体;正反应放热
D.A2、B2、AB均为气体;正反应吸热
18. 将8g Fe2O3投入150 mL某浓度的稀硫酸中,再投入7g 铁粉收集到168L H2(标准状况),
同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
A. 1.5 mol·L-1 B. 0.5 mol·L-1 C. 2 mol·L-1 D. 1.2 mol·L-1
17.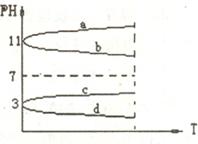 如图所示为电解质溶液的PH随外界条件T变化的图像
如图所示为电解质溶液的PH随外界条件T变化的图像 下列的叙述不正确的是
下列的叙述不正确的是
A.若T代表温度,Na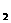 CO
CO 溶液符合曲线a的变化
溶液符合曲线a的变化
B.若T代表温度,醋酸稀溶液符合曲线d的变化
c.若T代表温度,明矾溶液符合曲线c的变化
D.若T代表加入水的量,氨水符合曲线b的变化
16. 将标况下1.12LCO2通入含有2gNaOH的水溶液中,完全反应并得到2L溶液,则对于该溶液表述正确的是
A.c (Na+)=2c (HCO3-) +2 c (CO32-) +2 c (H2CO3)
B.c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C.HCO3- 的电离程度大于HCO3-的水解程度
D.存在的平衡体系有:
HCO3-+ H2O
 H2CO3+OH-, HCO3-
H2CO3+OH-, HCO3-  H+ + CO32-
,H2O
H+ + CO32-
,H2O  H++OH-
H++OH-
15. 将一定体积稀硝酸溶液平均分为两份,一份与足量的铜粉反应收集到气体体积为V1;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(V1和V2都在同一条件下测定),已知V2=3V1,则稀硝酸和稀硫酸的物质的量浓度之比
 A.1︰1 B.1︰2 C.1︰3 D.无法确定
A.1︰1 B.1︰2 C.1︰3 D.无法确定
14. 由H2SO4、Al2O3、NaOH、Mg、Cl2两两之间进行反应,可制得的正盐有
A.5种 B.6种 C.7种 D.8种
13. 常温下,在下列溶液中一定能大量共存的离子组是
A.由水电离产生的c(H+)=l×10-10mol·L-1:Na+、Ba2+、Cl-、OH-
B.含有大量Fe3+的溶液:Na+、NH4+、Cl-、SO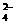
C.含有大量NO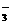 的溶液:Cl-、SO
的溶液:Cl-、SO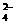 、Fe2+、H+
、Fe2+、H+
D.能与Al反应产生H2的溶液:Cl-、SO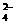 、Mg2+、K+
、Mg2+、K+
12. 下列有关实验操作的说法正确的是
A.可用25 mL碱式滴定管量取20.00 mL KMnO4 溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
11. 下列所述反应中,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的结果是
①金属钠在纯氧中燃烧; ②FeSO4溶液中滴入NaOH溶液;
③FeCL3溶液中滴入KSCN溶液; ④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
10. 某原电池总反应离子方程式为.2Fe3++Fe=3Fe2+ ,不能实现该反应的原电池是
A.正极为Cu,负极为Fe,电解质溶液为FeCl3 溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3 溶液
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com