
题目列表(包括答案和解析)
13.已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A.H2SeO3 B.HMnO4 C.H3BO3 D.H3PO4
12.Co(Ⅲ)的八面体配合物CoClm· nNH3 ,若1mol配合物与AgNO3作用生成1molAgCl沉淀,则m、n的值是( )
A.m=1 n=5 B.m=3 n=4 C.m=5 n=1 D.m=4 n=5
11.下列化合物中含有2个手性碳原子的是 ( )
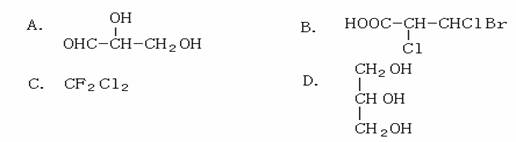
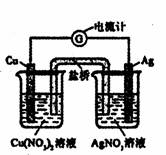
10.某装置如图所示,下列有关叙述正确的是 ( )
A.该装置为电解池
B.用铜导线代替盐桥,该装置依然能正常工作
C.该装置中总反应为;Cu+2Ag+=Cu2++2Ag
D.Ag一极的反应为:2H++2e一=H2↑
9.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
8.现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
7、下列各分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移的是( )
A、 BeCl2 B、 PCl3 C、 PCl5 D、 N2
6.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A.CO2 SO2 B. C2H4 CH4
C. C60 C2H4 D.NH3 HCl
5.下列说法正确的是( )
A.在元素周期表中,每个纵列的价电子层的电子总数一定相等
B.在元素周期表中,s区,d区和ds区的元素都是金属
C.可能存在核外电子排布为1s22s22p63s23p64s24p1的原子
D.在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区空间出现概率的大小
4、根据等电子体原理,下列分子或离子与SO42-有相似结构的是 ( )
A.PCl5 B.CCl4 C.NF2 D.N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com