
题目列表(包括答案和解析)
6、下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO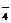 + 6H+ +
5H2O2 = 2Mn2+
+ 5O2↑ + 8H2O
+ 6H+ +
5H2O2 = 2Mn2+
+ 5O2↑ + 8H2O
5、下列判断正确的是
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
4、减缓温室气体排放是2009年哥本哈根气候变化会议的议题。下列反应不产生温室气体的是
A.用纯碱制玻璃 B.用煤炭作燃料
C.用铁矿石炼铁 D.用氨制碳酸铵
3、在298K、100kPa时,已知:2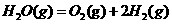 ⊿
⊿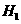
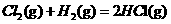 ⊿
⊿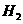
 ⊿
⊿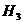
则⊿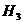 与⊿
与⊿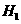 和⊿
和⊿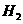 间的关系正确的是
间的关系正确的是
A
.⊿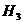 =⊿
=⊿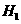 +2⊿
+2⊿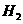 B
⊿
B
⊿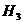 =⊿
=⊿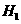 +⊿
+⊿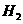
C. ⊿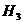 =⊿
=⊿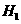 -2⊿
-2⊿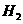 D. ⊿
D. ⊿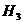 =⊿
=⊿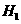 - ⊿
- ⊿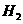
2、下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
1、以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能 B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
30.(12分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
① Z的原子序数为29,其余的均为短周期主族元素;K^S*5U.C#O
②Y原子价电子(外围电子)排布msnmpn ;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。该元素在周期表中的位置是 族。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。K^S*5U.C#O
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
;1 mol该晶体中含有 mol的化学键
福建师大附中2009-2010学年第二学期模块测试卷
高二化学《物质结构与性质》

K^S*5U.C#O
29.(11分)A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:K^S*5U.C#O
⑴ 写出A、C、E三种元素的符号:
A , C , E 。
⑵ 甲、乙两分子中含有非极性共价键的是 (填分子式),它的电子式为 。
⑶
C、D、F的离子中,半径最小的是
(填离子符号)
⑷ 在化合物BA4中元素B的杂化方式为: 杂化,BA4的空间构型为 。
⑸用氢键表示式写出液态D的氢化物中存在的氢键 
28.(6分)请回答下面问题
(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因:
。
(2)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ·mol-1)
|
|
C-O |
C=O |
C≡O |
|
CO |
357.7 |
798.9 |
1071.9 |
|
|
N-N |
N=N |
N≡N K^S*5U.C#O |
|
N2 |
154.8 |
418.4 |
941.7 |
CO与N2的结构相似,分子中都含有共价三键,其中含有 个π键;结合数据说明CO比N2活泼的原因:
。
27.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是( )
 A.N4属于一种新型化合物
A.N4属于一种新型化合物
B.N4与N2互为同位素
C.N4沸点比P4(白磷)高
D.1molN4气体转变为N2将放出882kJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com