
题目列表(包括答案和解析)
4、下列互为同系物的是( )
A. C2H4与C3H6Cl2 B.CH≡C─CH3与CH3─C≡C─CH3
C. C2H2与C6H6 D. 石墨与金刚石
3、下列有机物的命名正确的是( )
A. 1,2─二甲基戊烷 B. 2─乙基戊烷 C. 3,4─二甲基戊烷 D. 3─甲基己烷
2、 下列实验中,可以不用温度计的是( )
A.制乙烯 B.制溴苯 C.制硝基苯 D.石油分馏
1、下列各有机物中,属于烃的是( )
A、2-氯丁烷 B、硝基苯 C、甲苯 D、乙醇(CH3CH2OH)
31.(8分)碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过
杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
30.(8分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1)Ca原子结构示意图 。
(2)Ca与最活跃的非金属元素A形成化合物D,D的沸点比A与 形成的化合物E的沸点
(填高或低),用电子式表示D的形成过程
。
形成的化合物E的沸点
(填高或低),用电子式表示D的形成过程
。
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则M位于元素周期表中的位置是: 。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g.
29.(12分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1) L的轨道表示式为________ ;
(2)五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(3)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子空间构型为____________,A的电子式为____________,B的结构式为____________。
(4) 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层。该族2-- 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(5)工业上常用电解M2L3的方法来制取M单质。当制得54克M单质时,转移电子的物质的量是___________ mol。
28.(10分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y的元素符号是 。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。此反应的化学方程式是 。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
________________________________________________________________________________________________________________________________________。
27.(4分)A+,B2+,C-离子都由1-18号中某些元素组成。A+离子中键角为109°28',B2+离子中没有化学键。C-离子中有9个质子,具直线型结构。已知A+,B2+,C-均有10个电子。试回答:
(1)写出离子符号:A+______,B2+______,C-______。
(2)下列微粒:Ca2+,Ag+,质子,中子,哪些最易与C-结合为挥发性稳定化合物______。
26.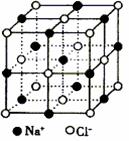 已知NaCl的摩尔质量为M g·mol-1,食盐晶体的密度为
已知NaCl的摩尔质量为M g·mol-1,食盐晶体的密度为
ρ g·cm-3,若右图中Na+与最邻近的Cl-的核间距离为a cm,那
么阿伏加德罗常数的值可表示为
A.M/a3ρ B.M/2a3ρ
C.2M/a3ρ D.2Ma3ρ
第Ⅱ卷(非选择题,共42分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com