
题目列表(包括答案和解析)
9、在某未知溶液中加入醋酸钠晶体后测得溶液中c(Na+)与C(CH3COO-)之比等于1:1,
对原来未知溶液的判断正确的是
A、可能是强酸溶液 B、可能是强碱溶液 C、可能是中性溶液 D、难以确定
8、已知 I-、Fe2+、SO 2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为
Cl-< Fe 2+< H2O 2 < I-< SO 2,则下列反应不能发生的是
(A)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (B)I2+SO2+2H2O=H2SO4+2HI
(C)H2O2+H2SO4=SO2+O2+2H2O (D)2Fe2++I2=2Fe3++2I-
7、下列有关阿伏加德罗常数的叙述正确的是
(A)1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
(B)1mol碳酸钠溶于水所得溶液中所含阴离子数大于0.1×6.02×1023个
(C)25℃时,1g水中约含有6.02×1013个OH-
(D)1molSiO2晶体中约含2×6.02×1023个Si-O键
6、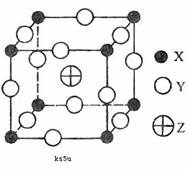 下列关于晶体的叙述中,错误的是
下列关于晶体的叙述中,错误的是
A.每摩尔Si晶体中,含有2摩尔Si-Si共价键
B.在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子
C.在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+
D.在简单立方堆积的金属晶体中,每个金属原子周围紧邻的有6个金属原子
不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
5、下列反应的离子方程式正确的是
A.碳酸钙跟醋酸溶液反应:CaCO3+2H+=Ca2++2H2O+CO2↑
B.澄清石灰水跟盐酸反应:H++OH- =H2O
C.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
D.碳酸氢钠溶液与足量的氢氧化钡溶液混合:
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
4、已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
3、下列轨道表示式能表示基态氮原子的核外电子排布的是
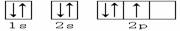
 A.
B.
A.
B.

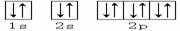 C.
D.
C.
D.
2、下列表达式错误的是
A.甲烷的电子式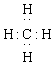 B.氟化钠的电子式
B.氟化钠的电子式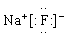
C.硫离子的核外电子排布式1s22s22p63s23p4 D.碳-12原子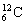
1、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1:1
18、(8分)(1)配制100mLpH为2浓度约为0.1mol·L-1的NH4Al(SO4)2溶液, 需NH4Al(SO4)2·12H2O固体 g。
(2)在0.1mol·L-1NH4Al(S O4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图
O4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图
①用NaOH溶液调节0.1mol·L-1NH4Al(SO4)2溶液pH至7,该过程中发生反应的离子方程式有
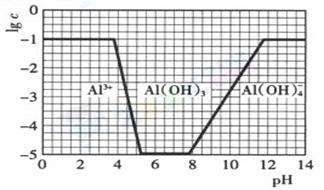 ②请在右图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图。(作图提示:注意开始沉淀,沉淀完全,沉淀开始溶解,沉淀完全溶解时的pH)
②请在右图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图。(作图提示:注意开始沉淀,沉淀完全,沉淀开始溶解,沉淀完全溶解时的pH)
19(16分)、X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X[ |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写酸的化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是
 。
。
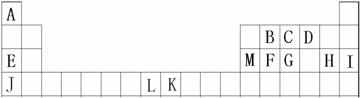 20(10分)、A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
20(10分)、A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
 (2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列
(填这些物质的序号)。
(2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列
(填这些物质的序号)。
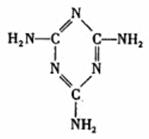
(3)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如右图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是 。
(4)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。
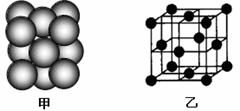
请回答:晶胞中M原子的堆积方式为 ,配位数为 。
21(10分)、碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子间通过 杂化与周围碳原子成 键(按电子云重叠方式填写)。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角 120°(填“>”“<”或“=”)。
 (4)洁净Pb的表面上存在C原子,右图为C原子在Pb的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表Pb原子)。则在图示状况下,Pb颗粒表面上Pb/C原子数之比为 。
(4)洁净Pb的表面上存在C原子,右图为C原子在Pb的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表Pb原子)。则在图示状况下,Pb颗粒表面上Pb/C原子数之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com