
题目列表(包括答案和解析)
4.在pH=13的无色溶液中,可以大量共存的一组离子是:( )
A.NH4+、NO3- 、K+、SO42- B.CO32_、NO3-、Al3+、Na+
C.Na+、ClO-、AlO2-、NO3- D.CrO42-、K+、Na+、SO42-
3.常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
2.已知:(1)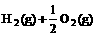 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2)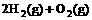 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3)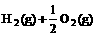 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
(4)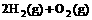 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是 ( )
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
1.下列说法不正确的是( )
A.需要加热才能发生的反应不一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应放热还是吸热
D.吸热反应在一定条件下(如常温、加热等)也能发生反应
18、(8分)(1)配制100mLpH为2浓度约为0.1mol·L-1的NH4Al(SO4)2溶液, 需NH4Al(SO4)2·12H2O固体 g。
(2)在0.1mol·L-1NH4Al(S O4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图
O4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图
①用NaOH溶液调节0.1mol·L-1NH4Al(SO4)2溶液pH至7,该过程中发生反应的离子方程式有
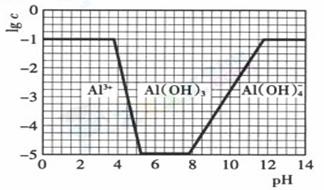 ②请在右图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图。(作图提示:注意开始沉淀,沉淀完全,沉淀开始溶解,沉淀完全溶解时的pH)
②请在右图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图。(作图提示:注意开始沉淀,沉淀完全,沉淀开始溶解,沉淀完全溶解时的pH)
19(16分)、X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X[ |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写酸的化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是
 。
。
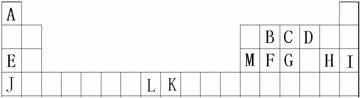 20(10分)、A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
20(10分)、A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
 (2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列
(填这些物质的序号)。
(2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列
(填这些物质的序号)。
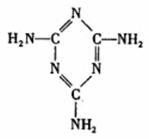
(3)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如右图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是 。
(4)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。
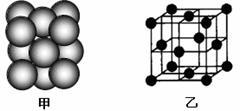
请回答:晶胞中M原子的堆积方式为 ,配位数为 。
21(10分)、碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子间通过 杂化与周围碳原子成 键(按电子云重叠方式填写)。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角 120°(填“>”“<”或“=”)。
 (4)洁净Pb的表面上存在C原子,右图为C原子在Pb的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表Pb原子)。则在图示状况下,Pb颗粒表面上Pb/C原子数之比为 。
(4)洁净Pb的表面上存在C原子,右图为C原子在Pb的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表Pb原子)。则在图示状况下,Pb颗粒表面上Pb/C原子数之比为 。
14、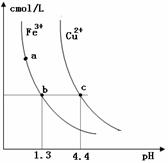 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的改变如图所示。据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的改变如图所示。据图分析,下列判断错误的是
A. Ksp[Fe( OH)3]< Ksp[Cu(OH)2]
OH)3]< Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由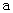 点变到
点变到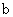 点
点
C.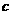 、d两点代表的溶液中c(H+)与c(OH-)乘积相等
、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.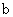 、
、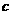 两点Fe(OH)3、Cu
两点Fe(OH)3、Cu (OH)2所在溶液分别达到饱和
(OH)2所在溶液分别达到饱和
非选择题
15(10分)、一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
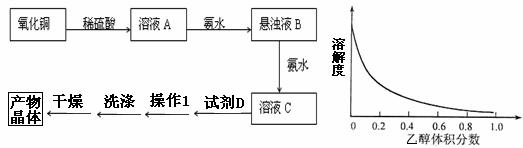
相关信息如下:
①(NH4)2SO4在水中可溶,在乙醇中难溶
②[Cu(NH3)4]SO 4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线如上示意图。[
4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线如上示意图。[
请根据以上信息回答下列问题:
(1)写出从悬浊液B到溶液C步骤中固体溶解的方程式 。
(2)试剂D为 ,操作1为
(3)下列选项中,最适合作为洗涤的洗涤液是 。
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
(4)干燥不宜 采用加热干燥的方法,可能的原因是 。
采用加热干燥的方法,可能的原因是 。
16(9分)、已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:KSP(CaF2)=1.5×10-10
②25℃时,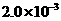 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
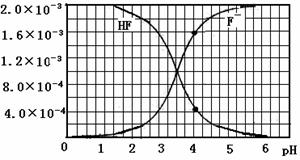
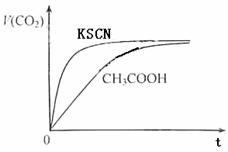
请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka 。
。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与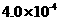 mol·L-1 CaCl2溶液等体
mol·L-1 CaCl2溶液等体 积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过计算判断
(填“是”或”否”)有沉淀产生。(在以下空白处写出计算过程)
积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过计算判断
(填“是”或”否”)有沉淀产生。(在以下空白处写出计算过程)
17(8分)、在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
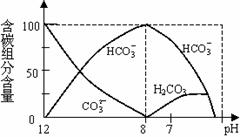 (2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的 各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如右图所示。
各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如右图所示。 回答下列问题:[
回答下列问题:[
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中的电荷守恒关系是: 。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=[ c(HCO3-)×c(OH-)]/c(CO32-)=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
13、 有关分散系的下列说法正确的是
有关分散系的下列说法正确的是
A.浊液的分散质可用过滤的方 法从分散剂中分离出来
法从分散剂中分离出来
B.任何物质在水中溶解时都有一定的溶解度
C.同一种溶质的饱和溶液要比不饱和溶液的浓度大一些
D.分散质粒子大小为1nm到100nm的分散系是胶体
12、下列有关物质的量 浓度溶液配制的叙述正确的是
浓度溶液配制的叙述正确的是
A.浓硫 酸稀释时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
酸稀释时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.定容时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.称量氢氧化钠固体时,应在托盘上放上一张称量纸以防止氢氧化钠腐蚀托盘
D.配制480mL0.1mol/LNa2SO4溶液,应称取7.1g Na2SO4
11、下列推断正确的是
A.SO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,均与 CO2发生化合反应
C.CO、NO、 NO2都是不成盐氧化物且都是大气污染物
D.酸性氧化物一定能与水反应生成酸
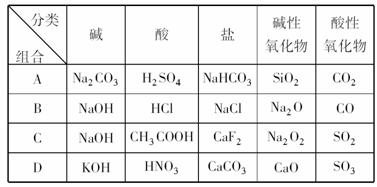
10、下列关于物质分类的正确组合是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com