
题目列表(包括答案和解析)
10.化学反应C(s)+H2O(g)
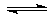 CO(g)+H2(g) △H>0 在密闭容器中达到平衡,下列叙述正确的是
CO(g)+H2(g) △H>0 在密闭容器中达到平衡,下列叙述正确的是
A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.体积不变,充入氮气使容器压强增大,平衡向逆反应方向移动
C.加入固体碳,平衡向正反应方向移动
D.减小压强,体积增大,平衡向正反应方向移动
|
温度 |
700℃ |
900℃ |
|
K |
1 |
2 |
9.在密闭容器中进行如下反应:NO(g)+CO(g)  1/2N2(g)+CO2(g),在不同温度下反应达到平衡时,NO的转化率如图所示,下列说法中正确的是
1/2N2(g)+CO2(g),在不同温度下反应达到平衡时,NO的转化率如图所示,下列说法中正确的是
 A.T1>T2,正反应是放热反应
A.T1>T2,正反应是放热反应
B.T1>T2,正反应是吸热反应
C.T1<T2,正反应是放热反应
D.T1<T2,正反应是吸热反应
8.一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是
A.16.7% B.20.0% C.80.0% 83.3%
7. 6. 250C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是( )
A、是吸热反应; B、是放热反应;
C、是熵减少的反应; D、熵增大效应大于能量效应。
6. 在一定温度下,下列叙述不是可逆反应 达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)2v正(B)=3v逆(C);(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)混合气体的平均相对分子质量保持不变时;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
4. 在密闭容器中A和B反应生成C,其反应速率分别用V(A).V(B).V(C)表示。已知三者之间有如下关系2V(B)=3V(A),3V(C)=2V(B)。则此反应可表示为
A.A+B=C B.3A+B=2C C.A+3B=2C D.2A+3B=2C
5. 在2A+B == 3C+4D反应中,下面表示的反应速率最快的是( )
A. VA=3.0mol·L-1·min-1 B. VB=0.28mol·L-1·S-1[来源:高&考%资*源#网]
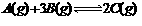 C. VC=4.8mol·L-1·min-1 D.
VD=1.0mol·L-1·S-1
C. VC=4.8mol·L-1·min-1 D.
VD=1.0mol·L-1·S-1
3. 已知热化学方程式: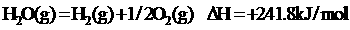
H2(g)+1/2O2(g)=H2O(l) △H=-285.8KJ/mol 当lg液态水变为水蒸汽时,其热量变化是
A.吸热88kJ B.吸热2.44J C.放热44kJ D.吸热44kJ
A.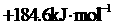 B.
B.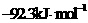 C.
C.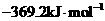 D.
D.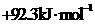
2.已知常温下64g甲醇完全燃烧放出1472 .6kJ 的热量,下列能正确表示甲醇燃烧热的热化学方程式的是
A. CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H=+736.3kJ/mol
B. CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H=-736.3kJ/mol
C. CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g) △H=-736.3kJ/mol
D. 2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H=-1472.6kJ/mol
20.(12分)工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得到强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。]请回答以下问题
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去? ,理
由是 ,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,理由是 现有
下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有 (有几个选
几个填代号) A.浓HN3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH的调整到3.7,可选用的有 (多选不限,填代号)
A. NaOH B.氨气 C.Cu(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
19.(12分)如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1;
c (OH-)- c (HA)= mol·L-1
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,
试推断(NH4)2CO3溶液的pH 7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列 (填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com