
题目列表(包括答案和解析)
24、(6分)2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。 (1)该氮氢化合物的电子式为 。 (2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,写出该反应的化学方程式 。 (3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式 。
23、(3分) 有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,
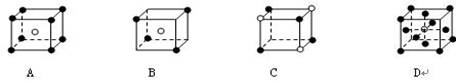
(1)则化学式为MN2的晶体结构为 。
(2)已知氯化铯晶体的密度为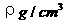 ,NA为阿伏加德罗常数,相邻的两
,NA为阿伏加德罗常数,相邻的两
个Cs+的核间距为acm,如图A所示,则CsCl的相对分子质量可以表示为 。
22、(14分)已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答:
(1)写出五种元素的名称:
A ; B ;C ; D ;E ;
(2)用电子式表示离子化合物A2B的形成过程: 。
(3)写出D元素形成的单质的结构式 。
(4)E、B两元素组成的化合物E2B2是由 键(填离子键,极性键或非极性键)形成的 分子(填极性分子或非极性分子)。
(5)D的氢化物的沸点比它同族相邻周期元素氢化物的沸点高的原因 。一种由B、D组成的化合物与CO2互为等电子体,其化学式为 。
21、(6分) 现有下列物质, 用编号填空回答下列各问: ①干冰 ②金刚石 ③ 氩晶体 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦氯化铵 ⑧水晶 ⑨ 钠 (1)只含有非极性键的晶体是 ;(2)固态时属于分子晶体的 是 ;(3)属于离子晶体的是 ;(4)不含化学健的晶体是 ;(5)含有非极性键的离子化合物是 。 (6)含有离子键、共价键、配位键的化合物是 。
20、(4分)某元素的激发态原子的电子排布式为1s22s22p63s24s1,则该元素基态原子的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物与烧碱反应的离子方程式是 。
19、A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为
A2-、C-,B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( ) A、离子半径A2-> C->B2+
B、它们的原子半径C>B>A
C、它们的原子序数A>B>C
D、原子最外层上的电子数C>A>B
第II卷(非选择题 共43分)
18、已知N2+O2==2NO为吸热反应,△H=+180KJ·mol-1,其中N≡N、O=O键的键能分别为946 KJ·mol-1、498 KJ·mol-1,则N-O键的键能为( )
A、1264 KJ·mol-1 B、632 KJ·mol-1
C、316 KJ·mol-1 D、1624 KJ·mol-1
17、超临界流体(Supercritical Fluid)是温度和压力同时高于临界值的流体,也即压缩到具有接近液体密度的气体,是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在中药、香料的萃取分离以及作为溶剂、发泡剂取代氟利昂等具有重要价值。下列有关说法中错误的是( ) A、超临界二氧化碳与CO2的物理性质不同,化学性质相同 B、超临界二氧化碳可能是一种原子晶体 C、用超临界二氧化碳溶解萃取物质,符合绿色化学的思想 D、用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
16、下列几组顺序排列不正确的是( )
A、微粒半径大小:S2->Cl->F->Na+>Al3+
B、热稳定性大小:HF>H2O>NH3 >PH3
C、熔点高低:金刚石>食盐>金属钠>冰
D、 沸点高低:HI>HBr>HCl>HF
15、下列说法正确的是①一切原子都由质子、中子、电子组成;②凡质量数相同的原子化学性质必定相同;③两种微粒结构中,如核外电子排布相同,其化学性质一定相同;④两种原子的核外电子排布相同,则它们一定属于同种元素;⑤单原子形成的离子一定具有稀有气体的电子层结构( ) A、 全部正确 B、②③ C、③⑤ D、④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com