
题目列表(包括答案和解析)
20.(6分)化学反应2SO2(g)+O2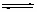 2SO3(g)是硫酸制造工业的基本反应。将0.05mol
2SO3(g)是硫酸制造工业的基本反应。将0.05mol
SO2(g)和0.03molO2(g)注入体积为1.0L的密闭反应器,在恒温环境中达到化学平衡后,测得反应器中有0.044molSO3(g), 求
(1)该温度下反应的平衡常数
(2)SO2的平衡转化率
19.(12分)在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g) 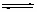 CO(g)+H2O(g) ,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)该反应为_________反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是__________(多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: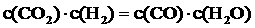 ,试判断此时的温度为____________℃。
,试判断此时的温度为____________℃。
18.(12分)在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)SO2的转化率为___________________;
(2)平衡时体系中SO2的百分含量(体积分数)为____________;
(3)平衡时c(O2)=______________mol/L;
(4)平衡时容器内气体压强与反应前的压强之比为___________。(最简整数比)
17、(3分) 已知下列反应的焓变
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
(2)C(s)+O2(g) ==CO2(g) △H2=-393.5kJ/mol
(3) 2 H2(g)+O2(g) ==2H2O(l) △H3= -285.8kJ/mol
试计算反应 2C(s)+2H2(g)+O2(g) ==CH3COOH(l)的焓变ΔH=
16、(6分)写出298K时,下列反应的热化学方程式
(1) 28 g CO还原Fe2O3生成单质铁,放出8.3 kJ热量;
(2) N2和O2化合生成184 g NO2气体,吸收热量135.4 kJ;
15.在一密闭容器中,反应aA(g) 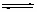 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数减小了 D.a>b
第II卷(非选择题,55分)
14.在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是( )
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
13、可逆反应:A(气)+ B 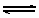 C(气)+D 中,A与C都是无色气体,当达到平衡时,下列叙述错误的是(
)
C(气)+D 中,A与C都是无色气体,当达到平衡时,下列叙述错误的是(
)
A、若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体
B、增大压强,平衡不移动,说明B、D必是气体
C、升温,C的百分含量减少,说明正反应是放热反应
D、若B是气体,增大A的浓度会使B的转化率增大
12.在容积一定的密闭容器中,可逆反应A(g)+B(g)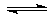 xC(g),有下图所示的关系曲线,根据下图下列判断正确的是(
)
xC(g),有下图所示的关系曲线,根据下图下列判断正确的是(
)
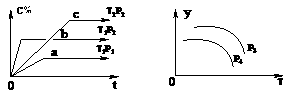
A、p3>p4,y轴表示A的转化率 B、p3<p4,y轴表示混合气体的密度
C、p3<p4,y轴表示B的质量分数 D、p3<p4,y轴表示混合气体的平均摩尔质量
11.一定条件下,某金属M与CO2发生反应:
M(s)+CO2(g) MO(s)+CO(g).该反应在不
MO(s)+CO(g).该反应在不
同温度下的平衡常数K见右表,下列叙述中正确的是
A.该反应是放热反应 B.增大压强可以提高M的转化率
C.通入足量的CO2,M可以完全转化为MO D.700℃时,平衡体系中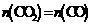
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com