
题目列表(包括答案和解析)
6、一定条件下,在N2+3H2 2NH3的化学平衡体系中,N2、H2、NH3的浓度分别为
2NH3的化学平衡体系中,N2、H2、NH3的浓度分别为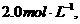
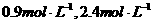 ,若起始时NH3有最大浓度,则起始时N2的浓度为( )
,若起始时NH3有最大浓度,则起始时N2的浓度为( )
A.0 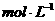 B.3.2
B.3.2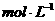 C.
C.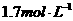 D.无法确定
D.无法确定
5、已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496KJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920kJ B.557kJ C.436kJ D.188kJ
4、已知充分燃烧a g C2H2气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则C2H2燃烧热的热化学方程式正确的是( )
A.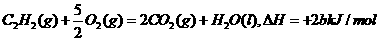
B.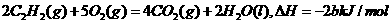
C.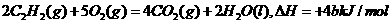
D.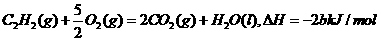
3、当可逆反应: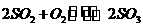 达到平衡后,通入
达到平衡后,通入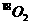 ,再达到平衡时,
,再达到平衡时, 存在于( )
存在于( )
A.O2中 B.SO2和SO3中 C.SO2、O2和SO3中 D.SO2和O2中
2、在一定条件下,向体积为2L的恒容密闭容器中加入2mol N2和10mol H2,发生反应: 时,测得剩余的N2为1mol,则化学反应速率的表示正确的是( )
时,测得剩余的N2为1mol,则化学反应速率的表示正确的是( )
 A.
A.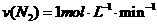 B.
B.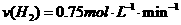
C.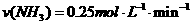 D.
D.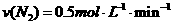
1、下列叙述中正确的是( )
A.化学反应一定有物质变化,不一定有能量变化
B.化合反应一定是放热反应
C.放热反应不需要加热就一定能发生
D.吸热反应不加热也可能发生
28.(7分)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH== 。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 。
27.(11分)电化学在工业生产中有广泛应用。
(1)右图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,
C(I)、C(II)为多孔石墨电极。
①电解NaCl饱和溶液的化学方程式为 。
②接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。则电极C(I)是 (填“阳”或“阴”) 极;检验C(II)电极反应所得气体产物的方法和现象是 。
③一段时间后(玻璃管中液面未脱离电极),断开S1,则C(I)、C(II)两玻璃管内气体的体积V(I)、V(II)的关系是:V(I) V(II)(填“>”、 “=”或 “<”) 。断开S1接通S2,电流表的指针发生偏转,此时电极C(II) 是 (填“正”或“负”) 极;C(I) 的电极反应是: 。
(2)若用此装置精炼粗铜,断开S2,接通S1,电解液选用CuSO4溶液,当电路中有0.04 mol电子通过时,阴极增重 g。
26.(7分)据报道,摩托罗拉公司开发了一种以甲醇为原料,以 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
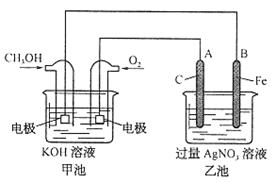
请填空:
(1)放电时:负极的电极反应式为____ _____。
(2)充电时:①原电池的负极与电源_________极相连。
②阳极的电极反应为__________________。
 (3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗
(3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗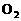 _________L(标准状况下)。
_________L(标准状况下)。
25.(7分)在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红。试回答下列问题:
(1)该溶液中HSO3-的电离程度______(填“大于”、“小于”或“等于”)HSO3-的水解程度。
(2)溶液中Na+、HSO3-、H+、OH-、SO32-等离子的浓度由大到小的顺序为 。
(3)在Na2SO3溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 。其原因是(以离子方程式及简要文字说明) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com