
题目列表(包括答案和解析)
31.在20℃时食盐的溶解度为36g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2L气体(标准状况)时,食盐恰好完全电解,所得溶液密度为1.20g·mL-1;试计算:(1)电解时,所取饱和食盐水的质量?
(2)电解后溶液中NaOH的物质的量浓度为多少?
(3)要使溶液恢复到原状态,需加入何种物质,其质量是多少克?
30.在557℃时密闭容器中进行反应:CO(g)+H2O(g)
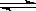 H2(g)+CO2(g)。若CO起始浓度为2 mol·L-1,水蒸气的起始浓度为3 mol·L-1,达到平衡后,CO2浓度为1.2 mol·L-1,求CO和H2O(g)的平衡转化率和平衡常数K。
H2(g)+CO2(g)。若CO起始浓度为2 mol·L-1,水蒸气的起始浓度为3 mol·L-1,达到平衡后,CO2浓度为1.2 mol·L-1,求CO和H2O(g)的平衡转化率和平衡常数K。
29、热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学体系的内能和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以 能的形式体现的。
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为 0(填“大于”、“小于”),该反应是 (填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH= 436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH= - 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ·mol-1
ΔH(H2)= 436 kJ·mol-1 ,ΔH(Cl2)= 247 kJ·mol-1
则ΔH(HCl)= 。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH= -25 kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH= - 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH= 19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
。
28、(7分)已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为 890 kJ( 填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的取值范围是 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是_____________
_____________________________________________________________________。
27、(11分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:_______________________________________________________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式为:_______________________________________________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_____________________________。
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
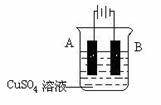
请回答:www.k@s@5@ 高#考#资#源#网
① A电极对应的金属是_____(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为__________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
26、某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
|
实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
|
t1 |
t2 |
||||
|
① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
|
② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
25.爱迪生电池在充电和放电时发生的反应:
 Fe+ NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是( )
Fe+ NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是( )
① 放电时,Fe参与负极反应,NiO2参与正极反应 ② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH- ③ 放电时,电解质溶液中的阴离子向正极方向移动 ④ 放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+ ⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A、只有③ B、③④ C、④⑤ D、①②⑤
第Ⅱ卷(非选择题 共72分)
24.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的:( )
A、NaOH固体 B、K2CO3溶液 C、CuSO4固体 D、CH3COONa固体
23.反应:NO+CO2 N02+CO在密闭容器中进行,下列哪些条件加快该反应速率:( )
N02+CO在密闭容器中进行,下列哪些条件加快该反应速率:( )
A、扩大体积使压强减小 B、体积不变充入CO2使压强增大
C、体积不变充入He气使压强增大 D、压强不变充入N2使体积增大
22、下列有关热化学方程式的叙述正确的是:( )
A、已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
B、已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定
C、含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4(aq)= 1/2Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol
D、己知C(s)+ O2(g)= CO2(g);△H1C(s)+1/2 O2(g)= CO(g);△H2 则△H1>△H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com