
题目列表(包括答案和解析)
22.(15分)(1)用惰性电极电解下列水溶液,请写出电极反应式及总反应式:
AgNO3: 阴极: 阳极:
总反应: 。
NaCl: 阴极: 阳极:
总反应: 。
(2) 用Cu电极电解下列水溶液(开始一段时间时),请写出电极反应式及总反应式:
Na2SO4:阴极: 阳极:
总反应: 。
H2SO4:阴极: 阳极:
总反应: 。
(3) 用Cu电极做阴极,C电极做阳极电解CuSO4水溶液,请写出电极反应式及总反应式:
阴极: 阳极:
总反应 : 。
21.(8分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 (填“酸”、“中”、“碱”)性 ,原因是(用离子方程式表示):
_____________________ _____________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
24. (8分)某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:
(8分)某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:

实验 序号 序号 |
铁的 质量/g 质量/g |
铁的 形态 形态 |
c/(H2SO4) /mol·L-1 /mol·L-1 |
V(H2SO4) /mL /mL |
溶液温度/℃ |
金属消失 的时间/s 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
铁片 |
0.7 |
50 |
20 |
36 |
250 |
|
2 |
0.10 |
铁片 |
0.8 |
50 |
20 |
35 |
200 |
|
3 |
0.10 |
铁粉 |
0.8 |
50 |
20 |
36 |
25 |
|
4 |
0.10 |
铁片 |
1.0 |
50 |
20 |
35 |
125 |
|
5 |
0.10 |
铁片 |
1.0 |
50 |
35 |
50 |
50 |
 分析上述数据,回答下列问题:
分析上述数据,回答下列问题:
 (1)实验2和3表明, 对反应速率有影响;
(1)实验2和3表明, 对反应速率有影响;
 (2)仅表明反应物浓度对反应速率产生影响的实验有
(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有
(填实验序号);
 (3)本实验中影响反应速率的其他因素还有
,能体现该影响因素的实验序号是 ;
(3)本实验中影响反应速率的其他因素还有
,能体现该影响因素的实验序号是 ;
 (4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
(4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
 原因是
原因是
 ;
;
 (5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
 。
。
23、(7分)下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
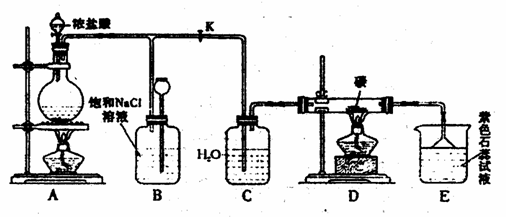
(1)A为氯气发生装置,写出反应的化学方程式: 。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式: ;装置C的作用是 。
(3)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此是B中的现象是 ,B的作用是 。
22、(11分)图为实验室制乙酸乙酯的装置。
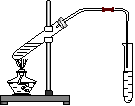 (1)该反应的化学方程式为
(1)该反应的化学方程式为
(2)装置中通蒸汽的导管要插在饱和Na2CO3溶液的液面以上,不能插在溶液中,目的是: ______________饱和Na2CO3的作用:
(3)浓H2SO4的作用: (1) (2)
(4)试管中加入沸石的作用:
(5)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(6)A同学将收集到的乙酸乙酯滴入含有少量酚酞的NaOH溶液中并在水浴中温热,发现溶液的红色逐渐变浅,由此得出乙酸乙酯中含有乙酸的结论,你认为这一结论正确吗?为什么?
答: 。
21、(6分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
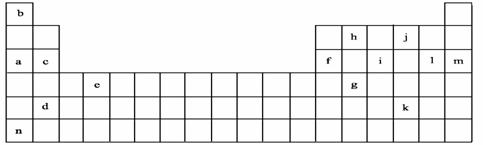
(1)e元素在周期表中的位置为 。画出g的原子结构示意图
。
(2)在上面元素周期表中画出金属元素与非金属元素的分界线。
(3)将元素a、f、h、b按原子半径从小到大的顺序排列 。(填元素符号)
(4)比较i和j形成的气态氢化物的稳定性 。(用化学式表示)
(5)比较i和l形成的最高价氧化物对应水化物的酸性 。(用化学式表示)
20、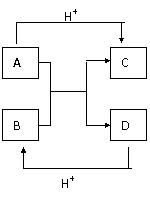 (4分)已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
(4分)已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B、C、D四种不同微粒的化学式:
A 、B 、C 、
D .
19、(4分)(1)把卷成螺旋状的铜丝在酒精灯的火焰上加热,使表面变黑,然后速伸到无水酒精中,有什么现象 ;写出有关反应的方
程式 。由此可见,铜丝在反应中起 的作用。
(2)(6分)某元素R气态氢化合物的化学式RH3,其最高氧化物中含氧7/
27,已知该元素的原子核中中子数和质子数相等,则该元素的相对原子质量是 ,元素名称是 ,请写出实验室制备RH3的化学方程式 ,请写出RH3做还原剂所发生反应的化学方程式 。
18、关于下列图示的说法中正确的是( )
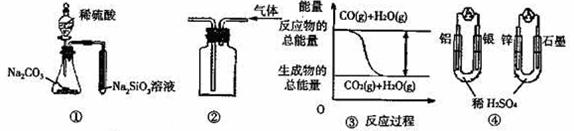
A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图 ② 所示实验装置排空气法收集CO2气体
 C.图 ③ 表示CO(g)+H2O(g) CO2(g)+H2(g)为吸热反应
C.图 ③ 表示CO(g)+H2O(g) CO2(g)+H2(g)为吸热反应
D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
第Ⅱ卷(非选择题,共46分)
17、某课外活动小组使用下列用品设计原电池。用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL,、烧杯。下列说法正确的是
A.该装置能将电能转化为化学能 B.实验过程中铜片逐渐溶解
C电子由铁片通过导线流向铜片 D.铁片上会析出红色的铜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com