
题目列表(包括答案和解析)
13.能说明醋酸是弱电解质的是( )
① 往碳酸钠溶液中加入醋酸有二氧化碳产生;② 醋酸钠溶液呈碱性;③ 可以用食醋清除热水瓶内的水垢;④ pH = 2的醋酸溶液稀释1000倍后pH小于5
A.①③④ B.①② C.②④ D.②
12.若溶液中由水电离产生的c(OH-)=1×10-14 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、HCO3- D.K+、NH4+、SO42-、NO3-
11.一定温度下,向容器为2 L的密闭容器通入两种气体发生化学反应,反应中各物质的物质的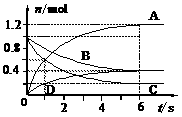 量变化如下图所示,对该反应的推断合理的是( )
量变化如下图所示,对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D 6A+2C
6A+2C
B.反应进行到1 s时,v (A) = v (C)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
10.下列关于电解质溶液的正确判断是( )
A.在pH =12的溶液中,K+、Cl-、Al3+、Na+可以共存
B.在pH=0的溶液中,Na+、NO3-、CO32-、K+可以共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3, 可推知NaA溶液存在A- + H2O HA + OH-
HA + OH-
9.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.对该反应体系加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
8. 在10 ℃时某化学反应速率为0.1 mol/(L·min),若温度每升高10 ℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L·nim),则该反应需在什么温度下进行( )
A.30 ℃ B.40 ℃ C.50 ℃ D.60 ℃
7. 已知一定质量的锌粒与稀盐酸反应(放热反应),生成H2的浓度与反应时间的关系如下图所示,下列结论不正确的是( )
已知一定质量的锌粒与稀盐酸反应(放热反应),生成H2的浓度与反应时间的关系如下图所示,下列结论不正确的是( )
A.若将锌粒改为锌粉,可以加快产生H2的速率
B.反应在2-4min内平均反应速率最大
C.反应前4min内生成H2的平均速率v (H2)=0.09mol·L-1·min-1
D.反应开始2min内平均反应速率最大
6.下列液体均处于25℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) >c(CH3COO-)
5. 把下列4种Na2S2O3的溶液分别加入4个盛有10mL 2mol·L-1硫酸的烧杯中,均加水稀释到50mL ,此时,Na2S2O3和硫酸进行反应。其中出现沉淀最快的是( )
A.20mL 3mol·L-1Na2S2O3的溶液 B.20mL 2mol·L-1Na2S2O3的溶液
C.10mL 4mol·L-1Na2S2O3的溶液 D.10mL 2mol·L-1Na2S2O3的溶液
4. 低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g) △H<0在恒容的密闭容器中,下列有关说法正确的是( )
低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g) △H<0在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,标志反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com