
题目列表(包括答案和解析)
3.下列说法正确的是( )
A.摩尔是物质的质量单位 B.氢气的摩尔质量是2g C.1molOH-的质量是17g D.气体摩尔体积就是1mol气体的体积是22.4L
2.垃圾处理无害化、减量化和资源化逐渐被人们所认识。垃圾的分类收集是实现上述理念的重要措施。某垃圾箱上贴有如右图所示的标志,向此垃圾箱中丢弃的垃圾是( )
 A.危险垃圾 B.可回收物
A.危险垃圾 B.可回收物
C.有害垃圾 D.其他垃圾
1. 2008的“绿色奥运”,提倡开一个环保的奥运,以下你认为不能采纳的是( )。
A.开发、使用无磷洗涤剂
B.用天然气代替汽油和柴油作发动机燃料
C.禁止未经处理的工业废水和生活污水的任意排放
D.使用添加剂抑制水中所有动植物的生长
23.(17分)工业制硫酸生产流程如下图:
|
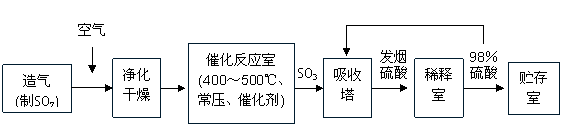

(1)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196
kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2mol SO2和1mol O2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是____________________________。 下列描述中能说明上述反应已达平衡的是___________
A.v(O2)正=2v(SO3)逆 B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
2SO3(g),ΔH=-196
kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2mol SO2和1mol O2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是____________________________。 下列描述中能说明上述反应已达平衡的是___________
A.v(O2)正=2v(SO3)逆 B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(2)在450℃、常压和钒催化条件下,在容积为5 L的容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol。
①求该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数K =__________,O2的平均消耗速率v(O2)=__________,和SO2的平衡转化率a(SO2)=___________。
2SO3(g)的平衡常数K =__________,O2的平均消耗速率v(O2)=__________,和SO2的平衡转化率a(SO2)=___________。
②若继续通入0.20molSO2和0.10molO2,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
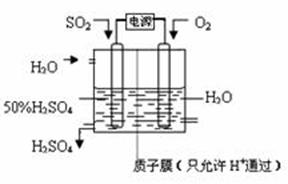 (3)科学家研究出以下图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
,总反应的化学方程式为
。
(3)科学家研究出以下图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
,总反应的化学方程式为
。
22.(8分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式__________________________________________
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)
假设一:______________________________________________________
假设二:________________________________________________________
21.(7分)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,镍镉可充电电池中的电解质溶液为KOH溶液,Cd(OH) 2、Ni(OH)2、NiO(OH)都难溶于KOH溶液但能溶于酸。它的充放电反应按下式进行:
 Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
⑴ 关于镍镉(Ni-Cd)可充电电池,说法中正确的是( )
A.以上反应是可逆反应 B、放电时电解质溶液中的OH-向正极移动
C.充电时阴极发生氧化反应 D、放电时化学能转变为电能
⑵ 放电时Cd作为__________极,电极反应式为_________________________
⑶ 废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
20.(14分)按下图装置进行实验,并回答下列问题
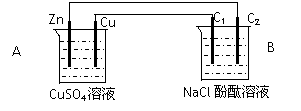
⑴ 判断装置的名称:A池为___________ B池为______________
⑵ 铜极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
⑶ 当C2极析出224 mL气体(标准状态时),锌的质量减少_________g,CuSO4溶液的质量增加_________g 。
19. (7分)已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:
2CrO42-(黄色)+ 2H + 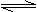
 Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
⑴该反应______氧化还原反应(填“是”或“不是”),反应的平衡常数表达式K=___________
⑵若要使溶液的橙红色加深,下列可采用的方法是_____________
A.加入适量浓盐酸 B.加入适量硝酸
C.加入适量烧碱固体 D.加水稀释
⑶ 已知下列离子在溶液中会呈现一定的颜色:MnO4-(紫红色)、Cr3+(紫色)、 CrO42-(黄色)、Cr2O72-(橙红色),往K2Cr2O7溶液(橙红色)中加入足量K2SO4固体,上述平衡________________ 移动(填向正反应方向、逆反应方向、不移动);再通入足量SO2气体,溶液____________ (填溶液颜色如何变化)。
18.(6分)能源是人类生存和发展的重要支柱。研究化学反应中的能量变化在能源紧缺的今天具有重要的意义:已知下列热化学方程式:
①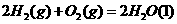

②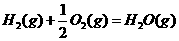
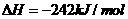
③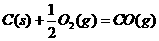
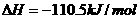
④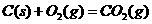
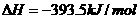
⑤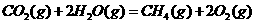

回答下列问题:
(1)上述反应中属于放热反应的是(填序号) 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测量,但可通过间接的方法求得。根据以上反应的△H值求出反应
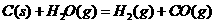 的
的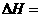 ;
;
该反应的熵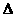 S
0(选填“>”、“=”、“<”);
S
0(选填“>”、“=”、“<”);
又已知: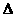 G=△H
G=△H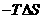 (T指温度),当
(T指温度),当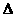 G<0时可自发进行。则该反应在什么条件下可自发进行
。(填高温或低温)
G<0时可自发进行。则该反应在什么条件下可自发进行
。(填高温或低温)
17、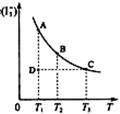 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) ,某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) ,某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为
K1、K2,则K1<K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
第Ⅱ卷 非选择题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com