
题目列表(包括答案和解析)
26.(10分)某课外活动小组进行电解饱和食盐水的实验(如图)。请同答下列问题。
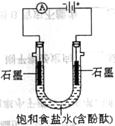
(1)通电一段时间后,可观察到_______________电极(填“阴
极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为
______________________________________________。
(2)该溶液电解反应的化学方程式为__________________。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为
 _________________________________________________。
_________________________________________________。
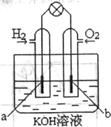
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成
新型燃料电池(如右上图),两个电极均由多孔性炭制成,通入的
气体由孔隙中逸出,并在电极表面放电。其中a是_________极
(填“正”或“负”),b极的电极反应式为_________________。
25.(9分)某研究小组将 溶液和
溶液和 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持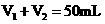 )。回答下列问题:
)。回答下列问题:
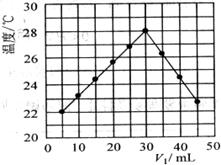
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______________________________________________________________________
____________________________________________________________________________。
(2)由题干及图形可知,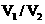 =
: 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________________mol·L-1。
=
: 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________________mol·L-1。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学
方程式:_______________________________________________________________________
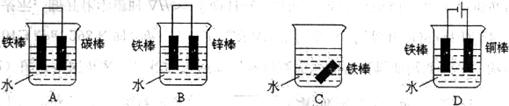
24.(6分)(1)下列哪个装置可防止铁棒被腐蚀____________________(多选倒扣分,下同)。
(2)近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为: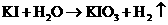 。下列有关说法中,正确的是__________________
。下列有关说法中,正确的是__________________
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
(3)用铂电极电解100mL HNO3与AgNO3的混合液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合液中Ag+的物质的量浓度为____________________
23.(7分)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应:
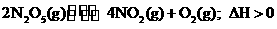
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”、“不变”)。
(2)下表为反应在T温度下的部分实验数据:
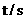 |
0 |
500 |
1000 |
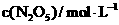 |
5.00 |
3.52 |
 2.48 2.48 |
则,500s内N2O5的分解速率为_______________。
(3)在孔温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。
则T2 __________ T1。(填“大于”“等于”或“小于”)
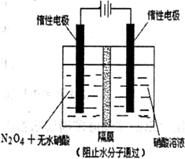
(4)如右图所示装置可用于制备N2O5
则N2O5在电解池的_______________区生成。
22.(5分)已知1 molCO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式___________________________________。
(2)若l molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为__________890 kJ(填
“ ”、“
”、“ ”、“
”、“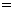 ”)。
”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水时,则放出热量(Q)的取值范围是___________________________________。
21. (5分)反应 在某温度下达到平衡。
在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______________________。
(2)若C为气体,且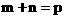 ,在加压时化学平衡发生移动,则平衡必定向___________反应方向移动。(填“正”或“逆”)
,在加压时化学平衡发生移动,则平衡必定向___________反应方向移动。(填“正”或“逆”)
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_________态。(填“气”“液”或“固”)
17.一定条件下,在容积为10L的密闭容器中,1molX和lmolY进行如F反应:
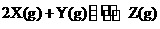 ,经60s达到平衡,生成0.3molZ,下列说法正确的是
,经60s达到平衡,生成0.3molZ,下列说法正确的是
A.以X浓度变化表示的反应速率为0.00l mol·L-1·s-1
B.将容器容积变为20L,Z的平衡浓度为原来的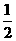
C.若增大压强,则正反应速率增大,逆反应速率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
第II卷(共49分)
15.已知两个热化学方程式:
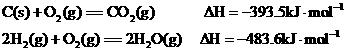
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
A.1:1 B.1:2 C.2:3 D.3:2
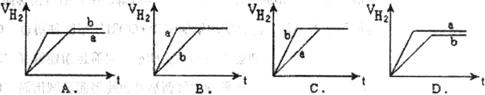
l6.等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是
14.已知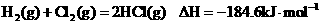 , 则反应
, 则反应
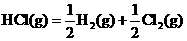 的△H为
的△H为
A.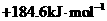 B.
B.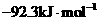 C.
C.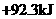 D.
D.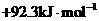
13.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A-D四个实验,你认为结论不正确的是
A.将相同大小形状的镁条和铝条与相同浓度的盐酸反应时,两者的速率一样大
B.相同条件下,等质量的大理石块和大理石粉末与相同的盐酸反应,大理石粉末反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com