
题目列表(包括答案和解析)
2、某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变为0.2mol/L,在这20s内它的反应速率为( )
A、0.8mol/(L.s) B、0.04mol/(L.s) C、0.02mol/(L .s) D、0.01 mol/(L .s)
1、在相同温度下,2H2(g)+ O2(g)=2H2O(g); △H= -a kJ/mol, 2H2(g)+ O2(g)=2H2O(l);
△H= -bkJ/mol两个反应放出的热a与b的关系是( )
A、a<b B、a>b C、a=b D、2b=a
21、(10分) 在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol/L, c(H2O)=0.03 mol/L, c(CO2)=0.01 mol/L, c(H2)=0.05 mol/L ,则反应开始时反应进行的方向是 (“朝正反应方向”,“朝逆反应方向”和“不能确定”)
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 , H2的转化率为 。
20、(12)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6 + I2 = C6H6O6 + 2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10mL 6mol/LCH3COOH,加入100mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000g样品,溶解于上述冷却的溶液中。加入1mL指示剂,立即用浓度为0.05000mol/L的I2溶液进行滴定,直至滴定终点,共消耗20.00mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)所用的指示剂为______________
(3)在滴定过程中,应用左手控制滴定管的_________(填部位),右手摇动锥形瓶,眼睛注视__________ ____,直到滴定终点。滴定至终点时的现象是________________。
(4)样品中维生素C的质量分数为_____________。
19、(9分)已知:铅蓄电池总反应的化学方程式为:
 Pb + PbO2
+ 2H2SO4
2H2O+ 2PbSO4 ;镍镉碱性充电池在放电时,其正极
Pb + PbO2
+ 2H2SO4
2H2O+ 2PbSO4 ;镍镉碱性充电池在放电时,其正极
反应为:2Ni O(OH) + 2e- + 2H2O = 2Ni (OH)2 + 2OH- ,负极反应为:
Cd + 2OH- - 2e- = Cd(OH)2 。回答下列问题:
⑴铅蓄电池在放电时的负极反应式为_____________________________________,
其在放电时正极反应式为___________________ _________________。
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为
_______________________________________________。
18、 (12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,
(12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
X电极的材料是 ,电极反应式是 。
(3)此装置若是在某金属上电镀铜,则①X电极的材料是 ,②Y电极的材料是 ,电解液a选用 溶液
17、(9分)已知:2H2(g)+ O2(g)=2H2O(g); △H= -484 kJ/mol,2H2(g)+ O2(g)=2H2O(l); △H= -572kJ/mol,若在标准状况下H2和O2组成的混合气体点燃,爆炸后再恢复到标准状况,生成液态水18克,则反应放出的热量是 ____________________kJ。
将0.3moL的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼的液态水,放出660kJ热量,该反应的热化学方程_________________________________________.又已知:H2O(l)=H2O(g) △H=+44kJ/mol,则2.24L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
16、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是:( )
A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
15、用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液
的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解
液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A、27mg B、54mg C、108mg D、216mg
14、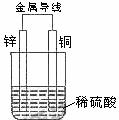 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )
A、铜是阳极,铜片上有气泡产生 B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片 D、氢离子在铜片表面被还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com