
题目列表(包括答案和解析)
5.下列物质中含有自由移动Cl-的是
A.KClO3固体 B.Cl2
C.HCl气体 D.KCl溶液
4.下列各组微粒中,互为同位素的是
A.金刚石和石墨
B.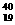 X和
X和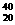 X
X
C.D2O和H2O
D.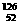 Y和
Y和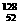 Y
Y
3.下列物质中既有离子键又有共价键的是
A.MgCl2 B.SiO2 C.H2O2 D.Na2O2
2.氢氧化钠与盐酸的反应属于
A.吸热反应 B.放热反应
C.既是吸热反应也是放热反应 D.都不是
1.下列情况不造成环境污染的是
A.燃烧液化石油气 B.燃烧管道煤气
C.燃烧氢气 D.燃烧木材
24、(12分,每空2分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρg/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
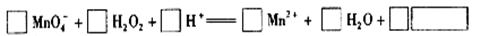 (3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________。
(4) 重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________。
(4) 重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
23、(10分,每空2分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
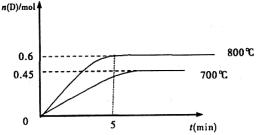 (1)800℃时。0-5min内,以B表示的平均反应速率为
。
(2)能判断该反应达到化学平衡状态的依据是
。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为
反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应
进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)800℃时。0-5min内,以B表示的平均反应速率为
。
(2)能判断该反应达到化学平衡状态的依据是
。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为
反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应
进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
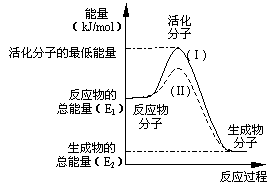
22、(10分,每空2分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。 (1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。 (2)已知热化学方程式:H2(g)+0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol 该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。 (3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________________。
21、(8分,每空2分)CO、CH4均为常见的可燃性气体。 (1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 (2)已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是 。 (3)120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强。 ①若混合气体与O2恰好完全反应,产生bmL CO2,则混合气体中CH4的体积分数为 (保留2位小数)。 ②若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表达式是 。
20、25℃时,向V mL PH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是 A.15 B.14 C.13 D.不能确定
第Ⅱ卷(非选择题,共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com