
题目列表(包括答案和解析)
25、(10分)某同学用标准 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的 溶液所需的玻璃仪器为
。
溶液所需的玻璃仪器为
。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
|
实验编号 |
盐酸的体积(mL) |
标准 溶液的体积(mL) 溶液的体积(mL) |
|
1 |
20.00 |
18.20 |
|
2 |
17.10 |
|
|
3 |
16.90 |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 (填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为 (结果保留三位小数)。
2010-2011学年度第一学期高中水平测试(二)
24、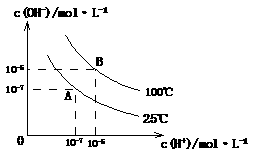 (12分)在水的电离平衡中,
(12分)在水的电离平衡中,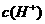 和
和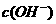 的关系如下图所示:
的关系如下图所示:
(1)A点水的离子积为1×10-14,B点水的离子积为 。造成水的离子积变化的原因是 。
(2)25℃时,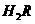 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:
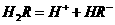 ,
,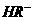
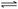
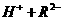 。
。
① 0.1 mol/L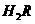 溶液的pH
1(填“>”、“<”或“=”)。
溶液的pH
1(填“>”、“<”或“=”)。
②在0.1 mol/L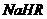 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01 mol/L 溶液的pH = 。
溶液的pH = 。
(4)100℃时,将pH =8的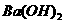 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则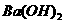 溶液与盐酸的体积比为
。
溶液与盐酸的体积比为
。
23、(10分)根据下式所示的氧化还原反应设计一个原电池: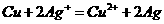
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图。
①注明原电池的正极和负极;
②注明外电路中电子的流向。
(2)写出两个电极上的电极反应。
22、(8分)在一定体积的密闭容器中,进行如下化学反应:
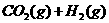
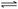
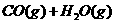 ,其化学平衡常数K和温度T的关系如下表:
,其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 (填“吸热”或“放热”)反应。
(3)能判断该反应已达到化学平衡状态的依据是( )
A、容器中压强不变
B、混合气体中 不变
不变
C、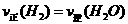 D、
D、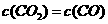
(4)某温度下,平衡浓度符合下式: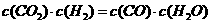 ,试判断此时的温度为
℃。
,试判断此时的温度为
℃。
21、(10分)25℃时,将0.01 mol 和0.002 mol
和0.002 mol 溶于水,形成1L混合溶液:
溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有七种不同的粒子(指分子和离子)。在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 ; 和 两种粒子物质的量之和等于0.01 mol。
20、燃料电池是燃料(如 、
、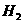 、
、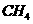 )等跟
)等跟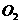 (或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如
(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如 )溶液,下列关于甲烷燃料电池的说法中不正确的是:
)溶液,下列关于甲烷燃料电池的说法中不正确的是:
A、负极的电极反应式为: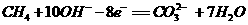
B、通入氧气的一极发生氧化反应,通入甲烷的一极发生还原反应
C、随着反应的进行,电解质溶液的pH保持不变
D、甲烷燃料电池的能量利用率比甲烷燃烧的大
19、甲酸和乙酸都是弱酸,当它们的浓度为0.10mol/L时,甲酸中的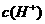 约为乙酸中
约为乙酸中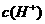 的3倍。现有两种浓度不等的甲酸溶液
的3倍。现有两种浓度不等的甲酸溶液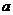 和
和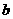 ,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为
,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为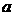 、乙酸、
、乙酸、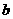 ,由此可知:
,由此可知:
A、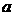 的浓度必小于乙酸的浓度 B、
的浓度必小于乙酸的浓度 B、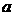 的浓度必大于乙酸的浓度
的浓度必大于乙酸的浓度
C、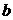 的浓度必小于乙酸的浓度 D、
的浓度必小于乙酸的浓度 D、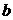 的浓度必大于乙酸的浓度
的浓度必大于乙酸的浓度
18、某温度下,在一容积可变的容器中,反应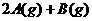
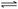
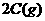 达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:
达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是:
A、均减半 B、均加倍
C、均增加1mol D、均减小1mol
17、已知某氢氧化物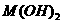 的溶度积常数为
的溶度积常数为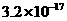 ,则
,则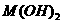 在水中的溶解度为:
在水中的溶解度为:
A、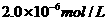 B、
B、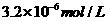
C、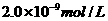 D、
D、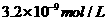
16、下列四组溶液的pH前者大于后者的是:
A、物质的量浓度相同的盐酸和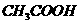 溶液
溶液
B、物质的量浓度相同的 溶液和氨水
溶液和氨水
C、pH=3的盐酸和pH=3的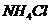 溶液均稀释100倍所得溶液
溶液均稀释100倍所得溶液
D、pH=10的 溶液和pH=10的
溶液和pH=10的 溶液均稀释100倍所得溶液
溶液均稀释100倍所得溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com