
题目列表(包括答案和解析)
6.下列事实不能说明Al的金属活动性比Cu强的是( )
A.常温下将铝投入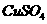 溶液中
溶液中
B.常温下将铝和铜用导线连接一起放入到稀盐酸溶液中
C.常温下将铝和铜不用导线连接在一起放入到稀盐酸溶液中
D.常温下将铝和铜用导线连接在一起放入到氢氧化钠溶液中
5.获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为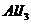 溶液,相关论文发表在J.Am,Chem.Soc.(128,8720-8721,2006)上,已知电池反应为
溶液,相关论文发表在J.Am,Chem.Soc.(128,8720-8721,2006)上,已知电池反应为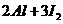 ===
===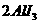 。下列说法不正确的是( )
。下列说法不正确的是( )
A.该电池负极的电极反应为: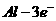 ===
===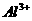
B.电池工作时,溶液中铝离子向正极移动
C.消耗相同质量金属时,用锂作负极时,产生电子的物质的量比铝多。
D.该电池可能是一种可充电的二次电池
4.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
① 固体 ②
固体 ②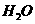 ③
③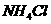 ④
④ 固体⑤
固体⑤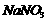 固体 ⑥
固体 ⑥ 溶液
溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
3.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L氢氰酸溶液的pH约为3 B.HCN易溶于水
C.10mL1mol/L HCN恰好与10mL 1mol/LNaOH溶液完全反应
D.HCN溶液的导电性比强酸溶液的弱
2.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
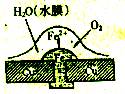 A.负极电极反应式为:
A.负极电极反应式为: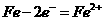
B.此过程中还涉及到反应: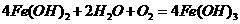
C.此过程中铜和铁均被腐蚀
D.此过程中电子从Fe移向Cu
1.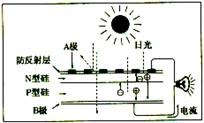 可再生能源是我国重要的能源资源,在满足能源需求、改变能源结构,减少环境污染、促进经济发展等方面具有重要作用,应用太阳能光伏发电技术,是实现节能减排的一项重要措施。
可再生能源是我国重要的能源资源,在满足能源需求、改变能源结构,减少环境污染、促进经济发展等方面具有重要作用,应用太阳能光伏发电技术,是实现节能减排的一项重要措施。
下列分析不正确的是( )
A.风能、太阳能、生物能等属于可再生能源
B.推广可再生能源有利于经济可持续发展
C.上图是太阳光光伏电池原理图,图中A极为正极
D.光伏发电池能量转化方式是太阳能直接转变为电能
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为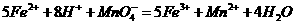 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。
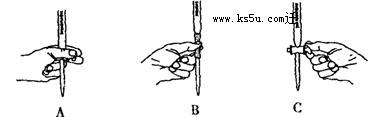
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
新余一中 宜春中学 高安中学三校高二年级联考
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
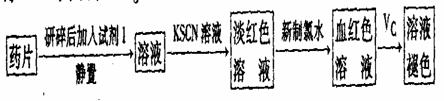
(1)加入新制氯水后溶液中发生的离子反应方程式是_________________________、
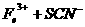
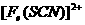 。
。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)向血红色溶液中加入一片Vc片,片刻后溶液血红色褪去,说明Vc有_______性;药品说明书中”与Vc同服可增加本品吸收”请说明理由_______________________。
17.(7分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
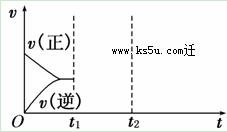 t2:降低温度
t2:降低温度
18.(10分)下表是不同温度下水的离子积的数据:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是
____________________________________________________________.
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,
则稀释后溶液中c(Na+)∶c(OH-)=________.
(3)在t2温度下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性.将此温
度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a∶b=________.
②若所得混合液pH=2,则a∶b=________.
19.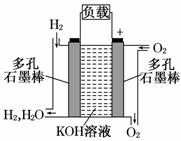 (10分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.
(10分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.
试回答下列问题:
(1)图中通过负载的电子流动方向________(填“向左”或“向右”).
(2)写出氢氧燃料电池工作时电极反应方程式.
正极:________________________________________________________________,
负极:________________________________________________________________,
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温及催化剂作用下 制取氢气.写出C3H8和H2O反应生成H2和CO的化学方程式:_________________;
(4)其它条件不变,若将此燃料电池改进为以甲烷和氧气为原料进行工作时,负极反应式为______________________________________________.
20.(11分)为了证明一水合氨(NH3·H2O)是弱电解质,常温下,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol/L氨水、0.1 mol/L NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水.
(1)甲用pH试纸测出0.010 mol/L氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“是”或“否”),并说明理由
______________________________________________________________________.
(2)乙取出10 mL 0.010 mol/L氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1 000 mL ,再用pH试纸测出其pH为b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系______________________.(用等式或不等式表示).
(3)丙取出10 mL、0.010 mol/L氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变_____(填“深”或“浅”).你认为这一方法能否证明NH3·H2O是弱电解质?________(填“能”或“不能”)并说明原因:__________________________________.
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:
________________________________________________________________________.
21.(14分)亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%-36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
15.下列四种溶液:
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;
④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
A.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
B.由水电离的c(H+):①=②>③=④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
16已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
A.该溶液的pH=4 B.降低温度,溶液的pH减小
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com