
题目列表(包括答案和解析)
2.某地区空气污染物指数为:SO2 78、NO2 43、可吸入颗粒163。下列说法正确的是
A.该地区的空气污染指数为284 B.该地区的空气污染指数为142
C.该地区空气质量等级为轻微污染 D.首要污染物为可吸入颗粒
1.我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是
A.尼古丁是由25个原子构成的物质
B.尼古丁中C、H、O 三种元素的质量比为:10:14:2
C.尼古丁的相对分子质量是162g
D.尼古丁中氮元素的质量分数为17.3 %
31.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,16 gN2H4在氧气中完全燃烧生成氮气,放出热量312 kJ。N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式是 。负极的电极反应式是 。
(3)下图是一个电化学过程示意图。
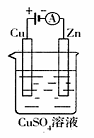
① 锌片上发生的电极反应是 。
② 假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
30. 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如下图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
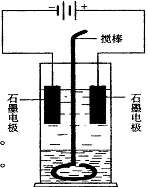
(1)阳极上的电极反应式为____________。
(2)阴极上的电极反应式为____________。
(3)原上层液体是____________________。
(4)原下层液体是____________________。
(5)搅拌后两层液体颜色发生变化的原因是__
(6)要检验上层液体中含有的金属离子,其方法是________,现象是____________。
29. 水的电离平衡如图所示:
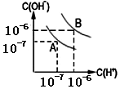
(1)若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从_____增加到_____。
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃时的恒温,于是混合物溶液的pH=7,则Ba(OH)2与盐酸溶液的体积比______
(3)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
28. 今有a(CH3COOH)、b(HCl)、c(H2SO4)三种溶液:
(1)当它们的C(H+)相同时,其物质的量浓度的关系是______。(用a、b、c表示)
(2)当它们的物质的量浓度相同时,其C(H+)的关系是______。(用a、b、c表示)
(3)中和同一烧碱溶液,需物质的量浓度相同的三种溶液的体积关系是______。(用b、c表示)
(4)体积、浓度都相同的b、c两溶液,分别与同浓度的NaOH溶液反应使反应后溶液呈中性,所需NaOH溶液的体积关系是_____。(用b、c表示)
27. 在稀氨水中存在下述电离平衡:NH3·H2O NH4++OH-
NH4++OH-
|
改变条件 |
平衡移动方向 |
C(H+) |
C(OH-) |
C(NH4+) |
|
微热(设溶质不挥发) |
|
|
|
|
|
通入氨气至饱和 |
|
|
|
|
|
通少量HCl气体 |
|
|
|
|
|
加少量NaOH固体 |
|
|
|
|
|
加少量NH4Cl固体 |
|
|
|
|
|
加水稀释 |
|
|
|
|
26. 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++xe-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
A. 锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B. 电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量小
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi++xe-=C6Li
25. 相同温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A. 中和时所需NaOH的量 B. 电离程度
C. 溶液中H+的物质的量 D. 醋酸的物质的量
24. 有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( )
A. Y>Z>W>X B. Z>Y>W>X
C. W>Z>Y>X D. X>Y>Z>W
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com