
题目列表(包括答案和解析)
5.考古学上常用碳元素的一种核素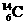 来测定文物的历史年代。
来测定文物的历史年代。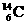 的原子核内中子数是
的原子核内中子数是
A.6 B.8 C.14 D.20
4.常温下,下列溶液可用铁制或铝制容器盛装的是
A.浓盐酸 B.浓硝酸 C.稀硫酸 D.稀盐酸
3.下列物质中,属于电解质的是 A.H2 B.Al C.CH4 D.H2SO4
2.下列关于二氧化氮的性质描述正确的是 A.无毒 B.无色 C.无味 D.红棕色
在下列各题的四个选项中,只有一个选项符合题意。(每小题2分,共50分)
1.“黑火药”是制造节日焰火的主要原料,一般含有硫黄、木炭和硝酸钾。“黑火药”属于
A.单质 B.化合物 C.混合物 D.有机物
25、(10分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol.
2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
2SO3(g),△H=-196.6kJ/mol.
2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) 。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为 。
24、(12分)将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。
根据以上资料回答下列问题:

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
__________________(选填“A”、“B”或“C”);

(2)图Ⅱ是1molNO2和CO反应生成CO2和
NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式:
___________________________________________;
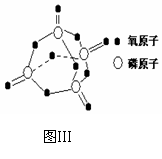 (3) 下表是部分化学键的键能数据:
(3) 下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能kJ/mol |
197 |
360 |
499 |
X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构(P4O10)如图Ⅲ所示,则上表中
 X=_______________________________。
X=_______________________________。
(4)图Ⅳ为氧族元素的氢化物
a、b、c、d的生成热数据示意图。
请你归纳:非金属元素的氢化物
的稳定性与氢化物的生成热(ΔH)
之间的关系:
_____________________________________。
23、(9分)(1)1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是____________。
A.Na+(g)+Cl-(g)―→NaCl(s);△Q
B.Na(s)+Cl2(g)―→NaCl(s);△Q1
C.Na(s)―→Na(g);△Q2
D.Na(g)-e-―→Na+(g);△Q3
E.Cl2(g)―→Cl(g);△Q4
F.Cl(g)+e-―→Cl-(g);△Q5
②写出△Q1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式________________________________________________________________________
(2)可逆反应:aA(g)+bB(g)  cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表
cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表 示这段时间内反应的平均速率应为__________ __。
示这段时间内反应的平均速率应为__________ __。
22、(15分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出肼和过氧化氢的电子式:肼___________________,过氧化氢______________ 。
(2)写出该反应热化学方程式:________________________________________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_____________________ kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:_____________________________________________________________________。
21、(14分)化学不仅为人类生活创造了丰厚的物质基础,而且为人类社会可持续发展做出了巨大贡献。
(1)蛋白质是生命的基础,是日常膳食的重要组成部分。下列食物:①黄瓜
②大豆 ③淀粉 ④鸡蛋 ⑤葡萄干,其中富含蛋白质的是
(填序号)。
(2)钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人,造成钢铁锈蚀的主要原因是发生电化学腐蚀。在电化学腐蚀中,水膜酸性较弱或呈中性时,发生吸氧腐蚀,其电极反应为:正极:O2+2H2O+4e-=4OH-;负极: 。水膜酸性较强时,发生析氢腐蚀,其电极反应为:正极:________________ _ 。
(3)生活中的水泥、普通玻璃和陶瓷都属于 (填“金属材料”或“无机非金属材料”和“高分子合成材料”),其生产原料不需要使用石灰石的是 。材料常常成为一个时代的标志,如陶器时代、青铜器时代、铁器时代。在信息时代,你认为信息技术的关键材料的的化学式是 。
(4) 碳酸氢钠是常见的疏松剂和抗酸药,请写出作抗酸药时的离子方程式
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com