
题目列表(包括答案和解析)
7.下列反应中铁元素发生氧化反应的是( )
A.FeS+2HCl=FeCl2+H2S↑ B.Fe+H2SO4=FeSO4+ H2↑
C.Fe2O3+3CO 2Fe+3CO2 D.2FeCl3+Cu=2FeCl2+CuCl2
2Fe+3CO2 D.2FeCl3+Cu=2FeCl2+CuCl2
6.下列物质中,不能电离出酸根离子的是( )
A.Na2SO4 B.Ba(OH)2
C.KMnO4 D.Na2CO3
5.当光束通过下列分散系时,能产生丁达尔效应的是
A.NaCl 溶液 B.Fe(OH)3胶体
C.CuSO4溶液 D.泥浆
4.下列各组离子,能在溶液中大量共存的是( )
A.Na+、Mg2+、OH- B.H+、SO42-、CO32-
C.Cu2+、SO42-、Cl- D.Ca2+、Cl-、CO32-
3.下列说法正确的是( )
A.1mol氧 B.SO42-的摩尔质量是96g
C.3mol小麦 D.标准状况下,1molO2和N2混合气体的体积约为22.4L
2.对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是
 |
 |
 |
 |
|
A |
B |
C |
D |
1、下列实验操作均要用玻璃棒,其中玻璃棒的作用相同的是:
①过滤 ②蒸发 ③溶解 ④向容量瓶转移溶液
A.①和② B.①和③ C.③和④ D.①和④
30.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)===CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O) d. c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________
31(14分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0
kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0
kJ·mol-1
某科学实验将6molCO2和8molH2充入体积为2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
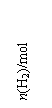
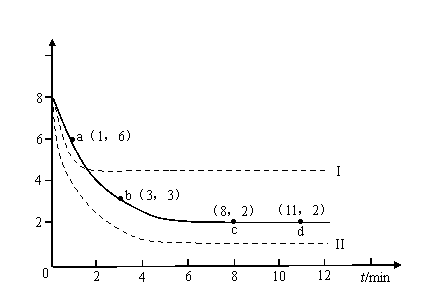

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是__________。
A.0-1min B.1-3min C.3-8min D.8-11min
(3)如果体积可变,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是__________ ,曲线II(更快平衡)对应的实验条件改变是___________ 。
(4)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
28.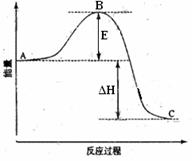 (8分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的
(8分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的
ΔH= -99kJ·mol-1。请回答下列问题:
(1) 图中E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”)。
(2)图中△H= KJ·mol-1。
 29(6分).某反应2A B+C,在某一温度时,达到平衡。
29(6分).某反应2A B+C,在某一温度时,达到平衡。
①.若B是固体,降低压强时,平衡向左移动,则A是___________态。
②.若A、B都是气态,加压时,平衡不移动,则C为 态。若同时该反应为 热(填吸或放),则该反应为自发反应。
27.(5分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)(3分)该反应的热化学方程式为
(2)(2分)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com