
题目列表(包括答案和解析)
1. (1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:____________________________________________ 。 (2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:________________________________________________________。
科学前沿
“非平衡态的引透”之谜
化学历来是以研究平衡态为己任的。打开任何一本化学教科书,都会发现化学平衡反应式举目皆是,诸如溶解平衡、电离平衡、水解平衡、化合反应平衡、沉淀溶解平衡、络合物平衡等等。在化学史上,许多化学家也以创立化学平衡原理而名垂青史,如德国化学家奥斯特瓦尔德,法国物理学家勒夏特列等等。近一个世纪以来,化学家们在化学平衡理论的指导下,取得了一系列重大的成就。然而,化学仅仅是研究平衡态的吗?早在本世纪20年代,丹麦的克里斯琴森和荷兰的克雷默斯两位化学家就提出了链式反应的机理。以后,苏联著名化学家谢苗诺夫经过长期研究,提出了著名的分枝链式反应机理,用化学反应流程图可表示如下:
反应物→反应历程→生成物
这一过程的相应实质是:平衡→非平衡→平衡
谢苗诺夫认为,任何化学反应之所以能够“一触即发”,都是由非平衡引起的,正是非平衡,才使物质由一种化学形态变成了另一种化学形态。因此可以说,非平衡态是化学反应的根源,而平衡态是化学反应的结果。一些科学家以氢和氯生成氯化氢为例,说明了非平衡态的重要性。从一个平衡态向另一个平衡态的过渡中,真是历经艰险,充满了非平衡态。
化学研究由平衡态向非平衡态的大转移,预示着化学家将“无视”许多平衡反应,而探索更多更新的非平衡问题。在非平衡态这块尚未完全开垦的处女地上,究竟能结出多少硕果?哪位化学家将摘录皇冠?我们将拭目以待。
第4节 离子反应
基础训练
1.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现每次取100.00mL进行实验。 (1)第一份加入AgNO3溶液有沉淀产生。 (2)第二份加足量NaOH后加热,收集到气体0.896L(标准状态下)。 (3)第三份加足量BaCl2后得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩2.33g。 试回答有关问题: ①判断K+、Cl-是否存在?K+ Cl- (填下列序号) A.一定存在 B.可能存在 C.一定不存在 ②肯定存在的离子的原溶液中的物质的量浓度分别为 。
2 .氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中 Ba(OH)2·nH2O的含量。 (1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100molL-1 HCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
15.用标准酸液滴定待测碱液时,下列操作对所测碱液的物质的量浓度有何影响。
A偏低 B偏高 C无影响
请用序号填空
(1) 用待测液润洗锥形瓶后再注入所量取的一定体积待测液___________________________________,
(2) 未用标准液润洗酸式滴定管就直接注入标准酸液_______________________________________ ,用滴定管尖端未排气泡的碱式滴定管量取待测碱液________________________________________,滴定前仰视读数、滴定后俯视读数_______________________________________________________,锥形瓶未润洗,且瓶中有少量蒸馏水___________________________________________________。
拓展提高
12.已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是 A.Al3+、Mg2+、Cl- B.CH3C00-、Ba2+、Br- C.Mg2+、Cl-、I- D.Na+、NH4+、Cl- 13.在一定条件下,RO3n-和I-发生反应的离子方程式如下: RO3n-+6I-+6H+=R-+3I2+3H2O (1)RO3n-中R元素的化合价是___________ (2)R元素的原子最外层的电子数是 . 14.向纯碱溶液中滴入酚酞溶液,观察到的现象是______________________,原因是
______________________________________________________;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是____________________,原因是________________________。
1.下列离子方程式书写正确的是 A.碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+ OH- =CO32- + H2O B.氯化铁溶液中通入硫化氢气体 2Fe3++S2-=2Fe2+ + S↓ C.次氯酸钙溶液中通人过量二氧化碳 Ca2+ + 2ClO-+H2O+CO2=CaCO3↓+2HClO D.氯化亚铁溶液中加入硝酸 3Fe2+ + 4H+ + NO3- =3Fe3+ + 2H2O + NO↑ 2.在某溶液中酚酞呈粉红色。下列离子在该溶液中不能大量存在的是 ( ) A.K+ B.Na+ C.Ba2+ D.Al3+ 3.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是 ( ) A.Na2O2 Al2(SO4)3 MgCl2 K2CO3 B.BaCl2 Na2SO4 (NH4)2SO4 KOH C.AgNO3 NaCl KCl CuCl2 D.Fe2(SO4)3 K2CO3 KHSO4 NH4Cl 4.有一无色未知液中检出了Ba2+、Ag+,同时又测知其酸性很强。某同学还要鉴定此溶液中是 否大量存在:①Cu2+ ②Fe3+ ③Cl- ④NO3- ⑤S2- ⑥CO32- ⑦NH4+ ⑧Mg2+ ⑨Al3+⑩AlO2- A、③⑤⑥⑦⑩ B、④⑦⑧⑨ C、①②⑤⑥⑦⑧⑨ D、①②③⑤⑥⑩ 5.在由水电离出的c(H+)= 1×10-13 mol·L-1的溶液中一定大量共存的离子组是 A. Fe2+, Na+, NO3-, Cl- B. Ba2+,Na+, NO3-,Cl- C.SO42-,S2O32-,NH4+,Na+ D.Mg2+,Na+,Br -,AlO2- 6.下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是 A.H+、Na+、NO3-、SO32- B.AlO2-、OH-、Na+、NH4+ C.Fe3+、SCN-、SO42-、Cl- D.Fe3+、HS-、Cl-、NH4+ 7.有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进 行实验。 (1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透 明溶液 (2)加热试管中的白色粉末,试管口有水滴凝结 (3)逐滴加入6 mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白
色不溶物 下列混合物中符合以上实验现象的是 ( ) A.NaHCO3、AgNO3 B.BaCl2、MgCO3 C.NH4HCO3、MgCl2 D.CaCl2·6H2O、Na2CO3 8.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是 (A)酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 (B)锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 (C)滴定时,没有逐出滴定管下口的气泡 (D)读数时,视线与滴定管内液体的凹液面最低处保持水平 9.用0.1mol.L-1 NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH
溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是 A.4 B.7.2 C.10 D.11.3 10. 在某无色透明溶液中,三种离子能大量共存的是 (A)NH4+、AlO2-、Na+ (B)Al3+、OH-、Na+ (C)Cu2+、Cl-、Na+ (D) Na+、CO32-、Cl- 11.浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于 A 1 B 2 C 3 D 4
3.解:(1)计算Fe3+离子定量沉淀完全所需溶液的最低pH值。
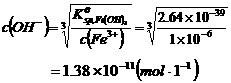
pH=3.14
(2)计算Fe2+离子不能生成Fe(OH)2沉淀时溶液的最高pH值:pH=6.49
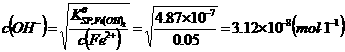
即溶液pH值应控制在3.14~6.49之间可将Fe3+离子沉淀完全而不生成Fe(OH)2沉淀。
2.解:反应式:Cu2++2H2S CuS+2H+
CuS+2H+
c(H+)=2×0.05=0.1mol·L-1
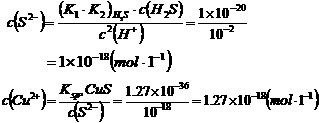
1.(1)S=1.1×10-4mol·L-1
(2) S=5.6×10-8mol·L-1
(3) S=1.18×10-6mol·L-1
15.QC=2.2×10-7>Ksp[Mg(OH)2],有Mg(OH)2白色沉淀生成。
拓展提高
14. 10.7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com