
题目列表(包括答案和解析)
6、在N2+3H2
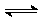 2NH3的反应中,经过t秒钟后,H2的浓度增加了0.9mol/L,在此期间,正反应速率V(H2)=0.45mol/(L·S),则t值为:
2NH3的反应中,经过t秒钟后,H2的浓度增加了0.9mol/L,在此期间,正反应速率V(H2)=0.45mol/(L·S),则t值为:
A. 1秒 B. 1.5秒 C. 2秒 .D. 2.5秒
5、下列关于反应热的说法正确的是:
A、 当∆H为负数时,表示该反应为吸热反应
B、 已知C(s)+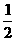 O2(g)=CO(g) △H =-110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g) △H =-110.5kJ/mol,说明碳的燃烧热为110.5kJ
C、 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D、 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
4、下列变化属于吸热的化学反应是:
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A、①④⑤ B、①②④ C、②③ D、②④
3.已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1, 则反应HCl(g)=H2(g)+Cl2(g)的
△H为 :
A.+184.6kJ·mol-1 B.―92.3kJ·mol-1 C.―369.2kJ·mol-1 D.+92.3kJ·mol-1
2.下列反应中,在高温下不能自发进行的是:
A.CO(g)=C(s)+1/2O2 △H>0
B.2N2O5(g)=4NO2(g)+O2(g)
C.(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9 kJ/mol
D.MgCO3(s)=MgO(s)+CO2(g)
1.下列叙述正确的是:
A.电能是二次能源 B. 水力是二次能源
C. 天然气是二次能源 D. 水煤气是一次能源
30.(8分) W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W在元素周期表中的位置 。W的气态氢化物稳定性比H2O(g)______(填“强”或“弱”)。
(2) Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_____________。
(3) 已知下列数据:Fe(s)+
 O2(g)====FeO(s) ΔH= -272.0 kJ·mol-1
O2(g)====FeO(s) ΔH= -272.0 kJ·mol-1
2X(s)+
 O2(g)====X2O3(s)
ΔH= -1675.7 kJ·mol-1
O2(g)====X2O3(s)
ΔH= -1675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是________________________。

29. (10分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 (填2种)。
 (3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
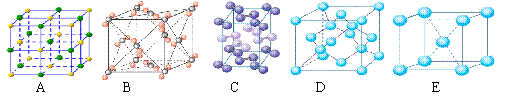 (4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
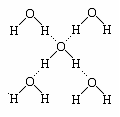
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
28.(12分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
27.(14分)氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)砷原子核外电子排布式为________________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是 。
 (3)已知:
(3)已知:
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是_________________________
______________________________________________________________________________。
② CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______________________
___________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com