
题目列表(包括答案和解析)
1、生活中的下列物质,属于氧化物的是
A.水 B.食盐 C.纯碱 D .酒精
24.(14分)
(1)vA vB。 气球B将
(2)αA将____ ____; _____ ___, 。
(3) 中的颜色较深。
(4) 。
23.(12分)
(1) v(HI)为____________。
(2)
①____________。 正确的是____________
②____________。
(3)
22.(12分)
(1)
__________________________________________________。 热反应。
(2)曲线是__________。 v=__________。
(3)达到平衡状态的是 。
(4) 。
www.k@s@5@ 高#考#资#源#网
21.(12分)
(1)设计意图是
________________________________________________________________________
________________________________________________________________________。
(2)颜色将 ,原因是______________________________________________
____________________________________________________________________________;
颜色将 ,原因是__________________________________________________
_____________________________________________________________________________
________________________________________________________________________。
(3)结论是________________________________________________________
________________________________________________________________________。
(4) 。
24.(14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)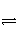
 N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
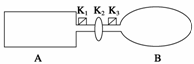
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA vB。(填“>”、“<”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不变”)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将 (填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 。
www.k@s@5@
高#考#资#源#网



 2011学年度下学期第一次段考高二级化学(理)试题答卷
2011学年度下学期第一次段考高二级化学(理)试题答卷
座位号:
23.(12分)在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:
H2(g)+I2(g)
 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
反应中各物质的浓度随时间变化情况如图1:
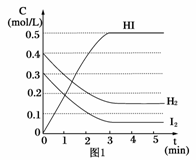
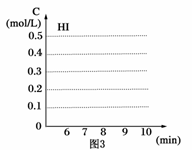
(1)根据图1数据,反应开始至达到平衡时,平衡速率v(HI)为____________。
(2)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K____________(填写增大、减小或不变)
HI浓度的变化正确的是____________(用图2中a-c的编号回答)
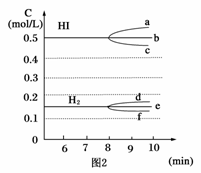
②若加入I2,H2浓度的变化正确的是____________。(用图2中d-f的编号回答)
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
www.k@s@5@ 高#考#资#源#网

22.(12分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g)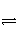
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=www.k@s@5@ 高#考#资#源#网
_______________________________________________________________________。
已知:K300℃>K350℃,则该反应是 热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0-2 s内该反应的平均速率v=__________。
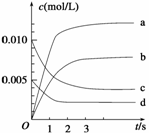
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
21.(12分)已知反应:2NO2(g)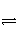
 N2O4(g),ΔH<0,为了探究温度对化学平衡的影响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol/L的HCl溶液和盛有500
mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。
N2O4(g),ΔH<0,为了探究温度对化学平衡的影响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol/L的HCl溶液和盛有500
mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。
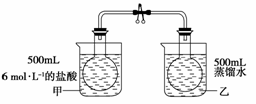
(1) 该实验用两个经导管连通的烧瓶,其设计意图是
________________________________________________________________________。
(2)向烧杯甲的溶液中放入125 g NaOH固体,同时向烧杯乙中放入125 g硝酸铵晶体,搅拌使之溶解。甲烧瓶内气体的颜色将 ,原因是
________________________________________________________________________;
乙烧瓶内气体的颜色将 ,原因是
________________________________________________________________________。
(3)该实验欲得出的结论是
________________________________________________________________________。
(4)某同学认为该实验的设计并不完全科学,他指出此时影响化学平衡的因素不止一个,你认为他所指的另一个因素是 。
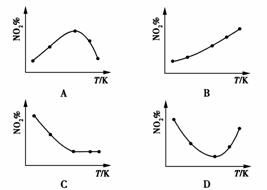
20.取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)
 N2O4(g),ΔH<0
N2O4(g),ΔH<0
反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com