
10、25℃时,水的电离可达到平衡:H2O= H++OH- △H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加 入少量固体CH3COONa,平衡逆向移动,c
入少量固体CH3COONa,平衡逆向移动,c (H+)降低
(H+)降低
D. 将水加热,Kw增大,pH不变
9、下列关于电解质溶 液的正确判断是K^S*5U.C#O%
液的正确判断是K^S*5U.C#O%
A.在pH = 12的溶液中,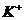 、Cl-、
、Cl-、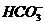 、
、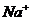 可以大量共存
可以大量共存
B.在pH= 0的溶液中,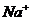 、
、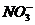 、
、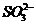 、
、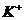 可以大量共存
可以大量共存
C.由0.1 mol·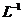 一元碱BOH溶液的pH=10,可推知BOH溶液存在
一元碱BOH溶液的pH=10,可推知BOH溶液存在
BOH=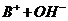
D.由0.1 mol·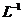 一元碱HA溶液的pH=3, 可推知NaA溶液存在A-
+ H2O
一元碱HA溶液的pH=3, 可推知NaA溶液存在A-
+ H2O HA + OH-
HA + OH-
8、HA为一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+ c(OH-)= c(A-)+ c(H+ )D.c(Na+)+ c(H+) = c(A-)+ c(OH-)
7.常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11
的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.②和③混合,所得混合溶液的pH大于7
B.③与④分别用等浓度的硫酸中和,消耗硫酸的体积:③=④
C.①与②分别与足量的镁粉反应,生成H2的量:①<②
D.若将四种溶液稀释100倍,溶液的pH大小顺序是:③>④>①>②
6.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这
四种酸在冰醋酸中的电离常数从以上表格中判断以下说法中不正确的是:
|
酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
5.下列叙述中,错误的是
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH—)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
4.下列说法正确的是
A.向0.1mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D. 分别与等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
3.对于0.1 mol·L-1 NH4Cl溶液,正确的是
A.升高温度,溶液pH升高 B.通入少量HCl,c(NH4+)和c(Cl-)均增大
C.c(NH4+) + c(OH-)=c(Cl-)+ c(H+) D.c(Cl-) > c(H+) > c(NH4+) > c(OH-)
2.下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO—
+ H3O+ B.CO2+H2O
HCOO—
+ H3O+ B.CO2+H2O H
H CO3— + H+
CO3— + H+
C.CO32—
+ H2O HCO3—
+ OH— D.HS— + H2O
HCO3—
+ OH— D.HS— + H2O S2—
+ H3O+
S2—
+ H3O+
一、单选题
1.下列溶液能与镁反应生成氢气的是
A.氯化铵溶液 B.氢氧化钠溶液 C.碳酸钾溶液 D.饱和石灰水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com