
 20.(9分)
20.(9分)
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转化关系如图所示(部分产物略去)。
(1)若A和E为单质且B物质为由极性键形成的非极性分子。B的电子式为: ,M的原子序数比A大76,则M位于元素周期表中第 周期 族。试写出M的最高价氧化物与浓盐酸反应得到单质气体C的化学反应方程式:
(2)若A、B、D、E均为高熔点的物质且E、D为单质,写出A→B的化学方程式: 。D的原子结构示意图: .
(3)若A为可溶性强碱(MOH),E为同主族元素形成的常见非金属化合物,且该化合物中两元素的质量比为l:1,试写出A→B的化学方程式:
19.(8分)
A、B、C、D、E五小烧杯透明溶液,分别是HCl、BaCl2、NaHSO4、K2CO3、AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式是 。
(2)A是 ,C是 ,D是
(3)A与E反应的离子方程式是
(4)某同学计划检验A中的阳离子,他还需要哪些仪器和药品:
(2)已知甲是同系列中最简单的化合物,且在标准状况下,5.6 L的甲完全燃烧放出的热量为325 kJ,试写出甲的燃烧热的热化学方程式
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式
(4)已知丙的晶体结构与NaC!相似,则该晶体中与D离子距离最近的D离子有 个;有资料显示,丙是一种危险物质,其反应活性很高,在潮湿的空气中能自燃。试写出相应的化学方程式
(5)A、B、C、D所对应元素的原子半径大小顺序为 (用元素符号表示)。
18.(11分)
A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期。它们中的两种元素可形成多种原子个数比为1:1的化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表:
化合物
甲
乙
丙
丁
元素种类
A、B
A、C
A、D
C、D
通常情况下,甲为气体,密度比空气小;乙为液体;丙和丁为固体且均为离子化合物。请填写下列空白:
(1)乙的电子式为 ,丁中阴离子与阳离子的个数比为

(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请用电子式表示LiH的形成过程:
(3)f与c或g均能形成一些化合物,据有关资料f与c能形成化合物fc6,f能与g能形成化合物f2g2。请回答下面问题:
①甲同学通过分析认为fc6此物质不可在O2中燃烧,原因是: ,通过测定知此物质中的6个c原子在分子结构中等效,则fc6分子空间构型为:
②乙同学通过查资料知化合物f2g2中既存在极性键,又存在非极性键,试写出其电子式: ;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液。试写出该过程的反应方程式:
(4)下列叙述正确的是
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c与h形成化合物的水溶液显中性
D.离子半径:f>g>h>d
E.f与d形成离子化合物为电解质,故该晶体能导电
F.a、d、e常见氧化物熔沸点高低比较:e>d>a
17.(13分)
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第VIA族和几种元素的位置。请回答下列问题:
2.答卷前,将密封线内的项目填写清楚。
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。
16.下列实验中,由于错误操作导致所测出的数据一定偏低的是
A.用量筒量取一定体积的液体时,俯视读出的读数
B.用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值
C.测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量
D.做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值
第Ⅱ卷(非选择题,共62分)
注意事项:
D.含有大量ClO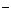 的溶液:H
的溶液:H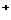 、Mg
、Mg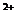 、I
、I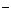 、SO
、SO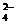
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com