
31.(8分)[化学一化学与技术]
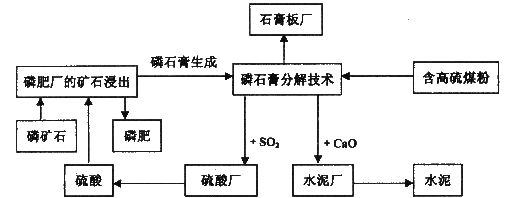
下面给出的图示是我省一综合企业集团中各工厂生产关系流程图,请你结合所学的知识对这一系统的技术原理、经济效益、环境影响、可持续发展的方面进行评价。(提示:CaSO4+C 2CaO+2SO2↑+CO2↑)
2CaO+2SO2↑+CO2↑)
30.(14分)下列物质A、B、C、D、X、Y、Z之间转化关系如下图所示:
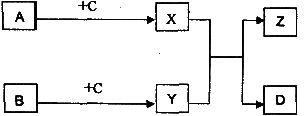
I.已知A、B为单质,D为无机化合物,其余均为有机化合物;A、B在一定条件下可化合生成D;Z具有芳香气味;X、Y均为生活中常见有机物;X在催化剂作用下可与B反应生成C;相同条件下,C的蒸气密度是H2密度的22倍。C中碳元素的质量分数为54.5%,氢元素的质量分数为9.1%,其余为氧元素。请写出:
①反应X+Y→Z+D的化学方程式:______________________
②A+C→X的反应类型:_______________________
③Y的一种同分异构体的结构简式:_______________________
Ⅱ.已知A、B、C、D为单质,X、Y、Z为无机化合物。
(1)若B、D为同一种物质,请写出反应X+Y→Z+D的化学方程式(写出一个即可):
___________________________________________
(2)若C、D为同一种物质:
①化合物Z中所含的元素为_________(用A、B、C表示)。
②反应X+Y→Z+D是否为氧化还原反应?请说明理由。
③某同学认为:C元素在化合物X、Y中呈现的化合价,必定是在一种物质中呈正价,在另一种物质中呈负价。请你判断该结论是否正确,并用有关的化学方程式证明你的结论。
[选做部分]
共6个题。考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(14分)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行探究:
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U型管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
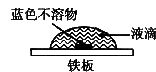 (2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]。)产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
(2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]。)产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
试判断该实验是否是铁的吸氧腐蚀。
若是,请写出正极反应方程式_______________________
若否,指出产生该现象的原因:________________________。
(3)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U型管中,请根据此装置在下面两项中择一回答:
①若不是原电池,请说明原因:______________________________
(如果回答次题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是:____________________________
(4)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:___。
28. (14分)将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
(14分)将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
H2O+CO CO2+H2;得到以下三组数据,据此回答问题
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡 所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
l |
650℃ |
lmol |
2mol |
0.6mol |
1.4mol |
5min |
|
2 |
900℃ |
0.5mol |
1mol |
0.2mol |
0.8mol |
3min |
|
3 |
900℃ |
a |
b |
c |
d |
t |
(1)①由以上数据,实验l中以v (CO2)表示的反应速率为_____________。
②该反应在650℃时平衡常数数值为______,该反应的逆反应为_____(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a,b应满足的关系为:__________。
(2)将0.2mol CO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是____________。
A.c(Na+)>c(HCO3-)>c(OH一)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH一)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为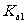 、Ka2,且
、Ka2,且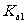 ≈
≈
104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为_________(用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为_______(用含Kh1的表达式表示)。
15.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是
A.Fe2+ B. Mg2+ C.Cl- D.Ba2+
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.下列对气体或溶液中的离子鉴定方案正确的是
A.将气体通入品红溶液中,品红溶液褪色,则证明该气体为SO2
B.向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中含CO32-
C.向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42-
D.向溶液中加入浓NaOH溶液,加热后产生使湿润的pH试纸变蓝的气体,证明原溶液中含NH4+
13.下表中的数据是破坏1mol物质中的化学键所消耗的能量(在25℃,101kPa下测定):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2
|
|
能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
下列叙述正确的是
A.上述物质中所含能量最低的是I2
B.H2(g)+Cl2(g)=2HCl(g) △H=+185kJ/mol
C.相同条件下,X2(X代表Cl、Br、I)分别与1 molH2 完全反应,Cl2放出的能量最多
D.在卤素单质X2 (X代表Cl、Br、I)中,Cl-Cl键键能最大,所以氯气化学性质最稳定
12.下列有关实验的叙述中,正确的是
①用湿润的pH试纸测定溶液的pH
②不宜用瓷坩埚熔融氢氧化钠固体或碳酸钠固体 .
③可用加热法分离I2和NH4Cl的混合物
④可用稀硝酸洗涤“银镜反应”实验后附着在试管壁上的银
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH),胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁粉
A.①②④ B.②⑧⑥ C.②④⑥ D.②③④⑤⑥
11.现有某温度下的KCl饱和溶液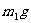 ,溶质的质量分数为
,溶质的质量分数为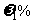 ,对其采取某种操作后析出mg无水KCl晶体,所得母液的质量为
,对其采取某种操作后析出mg无水KCl晶体,所得母液的质量为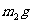 ,溶质的质量分数为
,溶质的质量分数为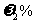 ,则下列关系正确的是
,则下列关系正确的是
A.原条件下KCl的溶解度等于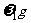 B.
B.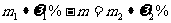
C.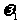 一定等于
一定等于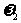 D.
D.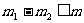
10.A元素原子最外层电子数是次外层电子数的2倍,B元素原子次外层电子数是最外层电子数的2倍。则A、B元素
A.可能是同一主族元素 B.一定都是第二周期元素
C.可能都是第三周期元素 D.一定是两种非金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com