
24.(7分)近年来,乳酸成为研究热点,其结构简式为 ,
,
试回答:(1)乳酸中含有的官能团的名称是___________、__________;若乳酸发生下列变化,请在箭号上填写所用试剂的化学式:


(2)某学生设计合成实验由乳酸制取高聚物 ,反应过程中涉及的化学反应的类型包括___________________。(按发生反应的顺序填写)
,反应过程中涉及的化学反应的类型包括___________________。(按发生反应的顺序填写)
(3)聚乙烯、聚氯乙烯等高分子材料因难分解而给环境带来“白色污染”。德国Danone公司首先开发出以乳酸为单体能在60天内自行降解的聚乳酸高分子材料,聚乳酸的结构简式为_____________;该反应的类型是__________。
23.(7分)下图方框中的字母分别表示一种反应物或一种生成物(其他无关的生成物已略去)其中A、C为无色气体。
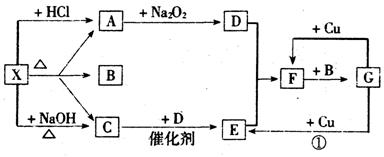
请填写下列空白:
(1)X的化学式 ,F的化学式 。
(2)写出C E的化学方程式:
。
E的化学方程式:
。
(3)写出G E的离子方程式:
。
E的离子方程式:
。
22.(6分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ,在此温度下,若该容器中含有1molCO2、 1.2molH2、 0.75molCO、 1.5molH2O,判断此时反应所处状态 (填序号)
A.正反应方向 B.逆反应方向 C.平衡状态
(3)充入2.0 mol A和1.0
mol B发生如下反应:2A(g)+B(g)  xC(g),达到平衡后,C的体积分数为w(C)。若维持容器体积和温度不变,改为充入0.6 mol A、0.3 mol B和1.4
mol C为起始物质,反应达平衡后,C的体积分数也为w(C),则x可能为
。
xC(g),达到平衡后,C的体积分数为w(C)。若维持容器体积和温度不变,改为充入0.6 mol A、0.3 mol B和1.4
mol C为起始物质,反应达平衡后,C的体积分数也为w(C),则x可能为
。
21.(10分)(1)美国“阿波罗”宇宙飞船中使用的氢氧燃料电池,其构造如图所示,
其反应为:
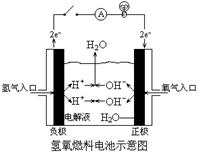
2H2+O2 2H2O,则负极通入的是 __________,
2H2O,则负极通入的是 __________,
电极反应式为:______ ____,
正极通入的是____________ __,
电极反应式为:__________________ ____。
如把KOH改为稀H2SO4做电解质,则负极反应式为: ____________________。
(2)用该燃料电池进行电解实验,如下图A极是铜锌合金,B极为纯铜,电解质为CuSO4溶液(其中含有足量的铜离子)。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,则A合金中含Cu的物质的量为
; 
20.在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01mol Cl2,有一半Br-变为Br2,则原溶液中HBr和H2SO3的浓度都等于 ( )
A.0.0075 mol·L-1 B.0.008 mol·L-1 C.0.075 mol·L-1 D.0.08 mol·L-1
第Ⅱ卷(非选择题,共40分)
19.M(NO3)2热分解化学方程式为:2M(NO3)2 2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是( )
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是( )
A.64g·mol-1 B.24g·mol-1 C.65g· mol-1 D.40g·mol-1
18.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应
Fe2O3+3Na2O2  2Na2FeO4+Na2O,下列说法正确的是 ( )
2Na2FeO4+Na2O,下列说法正确的是 ( )
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
17.2008年北京奥运会“祥云”火炬所用环保型燃料丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷的混合物,已知丙烷的标准燃烧热为:2221.5 kJ·mol-1;正丁烷的标准燃烧热为:2878 kJ·mol-1;异丁烷的标准燃烧热为:2869.6 kJ·mol-1,下列有关说法正确的是 ( )
A.正丁烷和异丁烷互为同系物
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.相同条件下,正丁烷的熔沸点比异丁烷高
D.丙烷燃烧的热化学方程式可表示为:
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
16.下列离子方程式书写正确的是 ( )
A.HClO在水溶液中的电离方程式:HClO=H++ClO-
B.铜片插入氯化铁溶液中:Cu+Fe3+=Cu2++Fe2+
C.向溴化亚铁溶液中通入过量的氯气 :2Fe2++Cl2=2Fe3++2Cl-
:2Fe2++Cl2=2Fe3++2Cl-
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
15.已知KSP (BaSO4)=1.07×10-10,室温下BaSO4在纯水中的溶解度为1.07×10-5mol·L-1,
则BaSO4在0.010mol·L-1 Na2SO4溶液中的溶解度是在纯水中溶解度的多少倍? ( )
A.0.1000 B.0.0100 C.0.0010 D.0.0001
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com