
28.(8分)苯丙酸诺龙是一种兴奋剂,结构简式为:
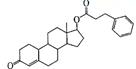
(1)由苯丙酸诺龙的结构推测,它能 (填代号)。
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应
d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:
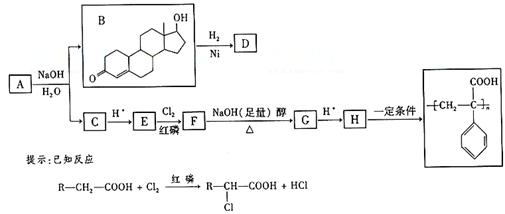
据以上信息回答(2)-(4)题:
(2)B→D的反应类型是 ;
(3)C的结构简式为 ;
(4)F→G的化学方程式是 。
27.(8分)A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生产盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)C元素离子的结构示意图是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 。(填化学式),B的10电子氢化物的分子空间构型为 。
(3)B与E可形成离子化合物BE5、BE5的电子式是 ,含有的化学键类型有 。
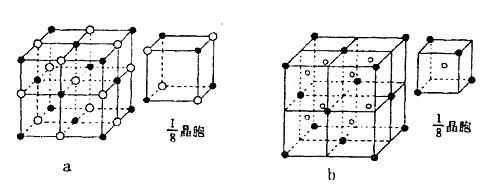
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合物结构是 (填字母标号a或b)
26.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为:8CuFeS2+21O2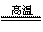 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放,b.用于制备硫酸,c.用纯碱溶液吸收制Na2SO4,d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方
法为:①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过
滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 ;
b.选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸 稀硫
酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 ;证明炉渣中含有FeO的实验现象为 。
25.(8分)物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的无色医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。
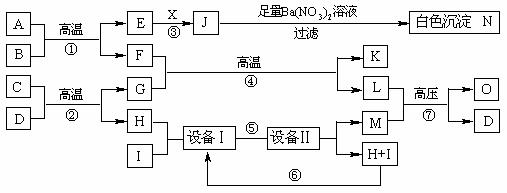
回答下列问题:
(1)X的化学式为_______________,
C+D的反应方程式为____ _______ __;
(2)写出反应⑦的化学方程式_____________________________________;
(3)现有1molA参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①的化学方程式为_____________________。
24.向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )
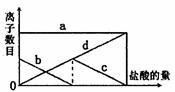
A.a:Cl-; b:K+; c:CO32-; d:HCO3-
B.a:K+; b:CO32-; c:Cl-; d:HCO3-
C.a:K+; b:CO32-; c:HCO3-; d:Cl-
D.a:K+; b:HCO3-;c:Cl-; d: CO32-
第II卷(60分)
|
23.如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇, 羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
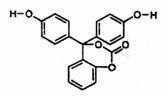
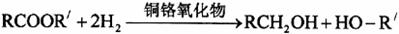
关于该化合物的下列说法中,不正确的是 ( )
A.该有机物的化学式为C20H14O5
B.该有机物可以与浓溴水反应
C.与足量氢氧化钠溶液充分反应,所得产物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应
22.某学生设计了如下图中的方法对A盐进行鉴定由此分析,下列结论中,正确的是( )
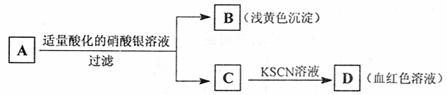
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
21.在等温等容条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:(Ⅰ) A和B的起始浓度均为2mol/L;(Ⅱ)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
C(g)+3D(g)。现分别从两条途径建立平衡:(Ⅰ) A和B的起始浓度均为2mol/L;(Ⅱ)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的各物质的量相同
B.达到平衡时,Ⅰ途径混合气体密度为Ⅱ途径混合气体密度的2倍
C.Ⅰ和Ⅱ两途径最终达到平衡时,体系内各气体的体积分数相同
D.达到平衡时,Ⅰ途径的反应速率VA等于Ⅱ途径的反应速率VB
20.等质量的单质A和化合物B分别和足量水反应产生C、D两种气体单质。一定条件下,产生的C和D两种气体单质恰好可完全反应,则下列判断中正确的是 ( )
A.A和B的摩尔质量相同
B.组成A、B的元素均为短周期元素
C.等质量的A和B所含的质子数相同
D.等物质的量的A和B与足量水反应产生的气体的体积比为(同温同压下)为2:1
19.2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65% 丁烷(C4H10)和35%丙烷,已知
CO:2CO(g)+O2(g)=2CO2(g),△H=-566.0 kJ/mol。
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),△H=-2221.5 kJ/mol。
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2878.0kJ/mol。
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2869.6kJ/mol。
下列有关说法正确的是 ( )
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com