
9.进行化学实验或探究活动,都必须注意实验安全。下列实验操作合理的是 ( )
A.为防止试管破裂,加热固体高锰酸钾制氧气时,试管口应略向下倾斜
B.进行SO2性质探究实验时,多余的SO2应排到实验室外
C.为防止药品污染,实验结束后,用剩的白磷可溶解于CS2后倒入垃圾箱
D.配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓H2SO4
8.下列离子方程式中正确的是 ( )
A.氯气通入水中Cl2+H2O = 2H+ +Cl- + ClO-
B.向Fe(OH)3中加入氢碘酸:Fe(OH)3 + 3H+ == Fe3++3H2O
C.金属铝溶于氢氧化钠溶液:2Al + 6OH- = 2AlO-2 + 3H2↑
D.向Fe(NO3)2稀溶液中加入盐酸:3Fe2+ + 4H+ + NO-3 == 3Fe3+ + NO↑+2H2O
7.下列说法中正确的是 ( )
A.LiH中H-离子的半径比Li-大
B.原子晶体中只存在非极性共价键
C.SO2与SiO2的化学键类型和晶体类型均相同
D.由非金属元素组成的化合物一定是共价化合物
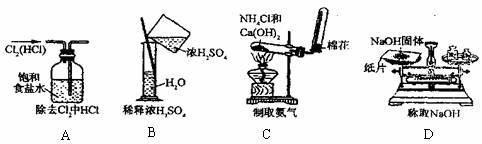
6.下列各图所示的实验原理、方法、装置和操作正确的是 ( )
5.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl === NaCl+N2↑+2H2O关于该反应的下列说法,正确的是 ( )
A.N2既是氧化剂,又是还原剂
B.每生成1molN2时,转移电子的物质的量为6mol
C.NH4Cl中的氮元素被还原
D.NaNO2是氧化剂
4.氯化铁溶液与氢氧化铁胶体具有的共同性质是 ( )
A.分散质颗粒直径都在1nm~100nm之间
B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
3.常温下,下列溶液中一定能大量共存的离子组是 ( )
A.含有大量Fe3+的溶液:SCN-、I、K+、Br-
B.无色澄清溶液:MnO-4、SO2-4、K+、Fe3+
C.能使pH试纸变红的溶液:NH+4、Na+、SO2-4、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO-3、NH+4、Cl-、Ca2+
2.在硫酸的工业制法中,下列生产操作与生产操作的主要原因的说明都正确的是 ( )
A.SO2氧化为SO3时采用常压,因为高压会降低SO2转化率
B.从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C.用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
D.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
1.下列说法不正确的是 ( )
A.任何化学反应伴随有能量变化
B.反应物总能量低于生成物的总能量时,该反应不能发生
C.反应物总能量高于生成物总能量的反应为放热反应
D.化石燃料在地球上的蕴藏量是有限的,而且又都是非再生能源
24.将15.68L(标准状况)的氯气通入70℃、500mL氢氧化钠溶液中,氯气发生了两个自身氧化还原反应,其氧化产物分别为次氯酸钠和氯酸钠。若取此溶液25.00mL。稀释到250.0mL。再量取此稀溶液25.00mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾。用浓度为0.2000mol/L硫代硫酸钠溶液滴定生成的碘:I2+2S2O32-=2I-+S4O62-,消耗硫代硫酸钠溶液5.00mL时恰好到终点。将滴定后的溶液再用盐酸酸化至强酸性,此时氯酸钠亦能氧化碘化钾,生成的碘再用上述硫代硫酸钠溶液滴定到终点,需要硫代硫酸钠溶液30.00mL。
(1)计算氯气反应后的溶液中次氯酸钠和氯酸钠的物质的量之比。
(2)写出符合上述条件的总化学方程式。
(3)若氢氧化钠溶液在通入氯气前后的体积变化可忽略不计,计算通入氯气后各生成物的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com