
4.某溶液中含有HCO3-、SO32-、S2-、ClO-等4种阴离子。若向其中少量的 Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A.ClO- B.SO32- C.S2- D.HCO3-
3.已知(1)HCl和NaOH反应的中和热ΔH=-57.3kJ/mol;
(2)CO(g)的燃烧热是283.0kJ/mol;则下列描述正确的是 ( )
A.H2SO4和NaOH反应的中和热ΔH=2×(-57.3)kJ/mol
B.2CO2(g) =2CO(g)+O2(g);ΔH=+2×283.0kJ/mol
C.1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(1); △H=-57.3kJ/mol
D.1mol甲烷燃烧所放出的热量是甲烷的燃烧热
2.下列有关氧化还原反应的叙述中正确的是 ( )
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,生成还原产物
1.下列试剂的浓溶液在空气中久置都会变质,在变质过程中只发生了氧化还原反应的是
( )
A.钠 B.过氧化钠 C.次氯酸钙 D.过氧化氢
(二)配制2 mol·L-1NaOH溶液250 mL,在下列所叙述的操作中选择必要的操作,用序号写出操作顺序 。
(1)在烧杯中放入一定量的水(少于250 mL),溶解NaOH。
(2)在托盘天平上放2张大小一样的纸,称取20.0 g NaOH。
(3)用滴管加蒸馏水,使溶液凹液面和刻度相切,摇匀。
(4)在烧杯中放NaOH,用托盘天平称出20.0 g NaOH。
(5)把20.0 g NaOH溶于250 mL蒸馏水中。
(6)待NaOH溶液冷却后,注入容量瓶(250 mL规格)。
(7)向容量瓶注入蒸馏水,直至液面接近瓶颈刻度线1-2 cm处。
(8)容量瓶用NaOH溶液润洗后使用。
(9)用蒸馏水洗涤烧杯2-3次,并把洗涤液注入容量瓶,振荡。
23.(12分)某溶液中存在Na+、SO42-、SO32-、Cl-、HCO3-、Br-中的若干种,依次进行下列实验,观察到现象记录如下。
①用pH试纸检验,溶液的pH>7;
②向溶液中滴加新制氯水,无气体产生,加入四氯化碳振荡、静置,四氯化碳层呈橙色,用分液漏斗分液;
③向分液后所得的水溶液中加入硝酸钡和稀硝酸的混合液,只有白色沉淀产生,过滤;
④在滤液中加入硝酸银和稀硝酸的混合液,有白色沉淀产生。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①_______________________。 实验②______________________________。
实验③_______________________。 实验④______________________________。
(2)结论:一定存在的离子__________________,不能确定的离子____________。
24.(10分)根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有___________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最小的金属元素的是___________,写出它的氧化
物与硫酸溶液反应的离子方程式____________________________。
(5)推测P、N最简单氢化物的稳定性_________大于_________(填化学式)。
25.(8分)为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
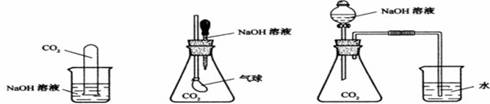
(甲) (乙) (丙)
(1)请写出CO2与过量的NaOH发生反应的离子方程式:
___ _____。
(2)选择任意一种实验装置,简述预计出现的实验现象,解释产生该实验现象
的原因: 你选择的实验装置是 ,实验现象是 ____ ____。
解释产生该实验现象的原因: ________。
26.(6分)(1)将0.15mol·L-1稀硫酸V1mL与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2= 。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合而得,则溶液
的pH 7(填大于、小于或等于)。
②若溶液pH>7,则c (Na+) c(A-) (填大于、小于或等于),理由是
。
27.(9分)河水中NaCl的质量分数大于0.3 % 时,则不能用来灌溉田地。取河水50mL,恰与10mL 0.2 mol·L-1的AgNO3溶液完全反应,生成不溶于稀硝酸的白色沉淀。
已知:0.3 % 的NaCl(aq)的密度为1.05g·cm-3
(1)计算该河水中NaCl的物质的量浓度。
(2)通过计算说明该地河水是否可用于灌溉。
21.(10分)按要求完成下列式子
(1)HClO的电离方程式:
(2)NaHSO4 与NaHCO3溶液混合的离子反应方程式:
(3)写出一个能用SO42- + Ba2+ == BaSO4↓表示的化学反应方程式:
(4)碳酸氢钠与过量氢氧化钙溶液反应的离子方程式
(5)碘酸钾与碘化钾在酸性溶液中反应生成碘单质的离子方程式
22.(5分)(一)某学生用中和滴定实验方法,以标准酸液(盐酸)测定未知浓度的氢氧化钠溶液时,过程如下:(1)取一支碱式滴定管;(2)用蒸馏水洗净;(3)即加入待测的NaOH溶液;(4)记录液面刻度读数;(5)用酸式滴定管精确放出一定量标准酸液;(6)置于未经标准酸液润洗的洁净的锥形瓶中;(7)加入适量蒸馏水;(8)加入酚酞试液两滴;(9)滴定时,边滴边振荡;(10)边注视滴定管内液面的变化;(11)当小心滴到溶液由无色变为粉红色时,即停止滴定;(12)记录液面刻度读数;(13)根据滴定管的两次读数得出NaOH溶液体积为22mL。指出上述实验过程中错误之处(用序号表示) ,其中一定会造成结果偏低的是___________________。
20.以下操作会使结果偏高的是 ( )
A.在转移液体前容量瓶中有少量蒸馏水;
B.定容摇匀后,液面已低于容量瓶刻度线,此时再加水;
C.转移时有少许液体沿容量瓶外壁流到实验桌上;
D.定容时俯视液面。
19.下列溶液中的氯离子数目与50mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是( )
A.150mL 1mol·L-1的NaCl B.75mL 2 mol·L-1的CaCl2
C.150mL 3mol·L-1的KCl D.75mL 2 mol·L-1的NH4Cl
18.标准状况下,aLHCl溶于1000g水中,得到的盐酸密度为bg·mL-1,则该盐酸浓度是( )
A.a/22.4 mol·L-1 B.ab/22400 mol·L-1
C.ab/(22400+36.5) mol·L-1 D.1000ab/(22400+36.5a) mol·L-1
17.a mol O2气体和a mol O3气体相比较,下列叙述一定正确的是 ( )
A.体积相同 B.质量相等 C.原子数相等 D.分子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com