
35.(4分) 甲、乙两同学做用氢气还原纯氧化铜实验,实验结束后,甲同学观察到乙同学的产品中略带砖红色,甲提出乙的实验产品含有杂质,并正确推测了乙同学产品中的杂质,乙同学说自己的产品是黄铜(CuZn合金)。已知CuO、Cu2O都是碱性氧化物,其中Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。回答下列问题:
(1)乙同学说自己的产品是黄铜你认为是否正确 (请用正确或错误回答)
(2)你分析甲推测乙产品中所含的杂质是 (填化学式)
(3)(答本题时一定要先写相关的化学用语,后用文字叙述,在文字叙述中要包括操作、现象、结论)请你帮助甲设计实验证明甲的推测
34.(10分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
、
33.(4分)熔融盐燃料电池具有高的发电效率,因而受到重视,可用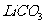 和
和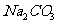 的熔融盐混和物作电解质,CO为负极燃气,空气与CO2的混和气为正极气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
的熔融盐混和物作电解质,CO为负极燃气,空气与CO2的混和气为正极气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
电池反应式:
阳极反应式:2CO+2CO32 →4CO2+4e
阴极反应式:_____ ______ 总电池反应:______
32.(3分)(1)1mol丙酮酸(CH3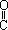 COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是
。
COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是
。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是 。
(3)B的甲酯可以聚合,聚合物的结构简式是 。
31.(3分)光化学烟雾形成的化学过程是:当汽车尾气产生的NO2在日光照射下分解成为NO和氧原子时,即开始光化学烟雾的循环,不断地产生O3。这个循环包括了下列3个化学方程式,请补充化学方程式b。
① a NO2 NO+O
NO+O
b
c O+O2→O3
②写出以上3个化学反应的净结果:
③汽油主要成分是烷烃,在燃烧不完全时,部分烷烃热裂。试写出由热裂产物2-丁烯被臭氧氧化生成乙醛(烟雾物质之一)并释放出氧气的化学方程式:
30.在氧气中灼烧0.44g硫和铁组成的化合物,使其中的硫全部转变为二氧化硫, 把这些二氧化硫全部氧化并转变为硫酸.这些硫酸可以用20.00mL0.50mol/L氢氧化钠溶液完全中和.则原化合物中硫的质量分数为 ( )
A.18% B.46% C.53% D.36%
第II卷(非选择题 共50分)
29.下列对叙述不正确的是 ( )
A.电离度是在一定条件下,在弱电解质溶液中,已电离的弱电解质物质的量占弱电解质总的物质的量的百分数.
B.化学平衡常数的大小可以表示一定条件下可逆反应正反应限度的大小
C.水的离子积常数在纯水或稀溶液中和温度有关.
D.难溶电解质的溶度积常数和温度有关
28.某有机物甲经氧化后得乙(分子式为C2H3O2Cl);而甲经水解可得丙.1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2).由此推断甲的结构简式为 ( )
A.CH2ClCH2OH B.ClCH2OCHO C.CH2ClCHO D.HOCH2CH2OH
27.在373K时,把0.5molN2O4气通入体积为5L 的真空密闭容器中,立即出现棕色.反应进行到2s时,NO2的浓度为0.02mol/L.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是 ( )
A.前2s,以N2O4的浓度变化表示的平均反应速度为0.01mol/(L•s)
B.在2s时体系内的压强为开始时的1.1倍
C.在平衡时体系内含N2O40.25mol
D.平衡时,如果压缩容器体积,则可提高N2O4的转化率
26.将pH值为8的NaOH溶液与pH值为10的 NaOH溶液等体积混和后,溶液中的氢离子浓度最接近于 ( )
A.1/2(10-8 + 10-10)mol/L B.(10-8 + 10-10)
C.(1×10-14 + 5×10-5)mol/L D.2×10-10mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com